
- •Глава 6. Давление диссоциации соединений, не растворимых в металле
- •Контрольные вопросы.
- •Глава 7. Давление дисооциации соединений, растворимых в металле
- •Контрольные вопросы
- •Коэффициенты для расчета проницаемости водорода через металл по уравнению:
- •Коэффициенты для расчета диффузии в твердых металлах по уравнению:
- •Растворимость водорода в металлах,образующих экзотермические растворы (760 мм. Рт.Ст):
Глава 7. Давление дисооциации соединений, растворимых в металле
Вещества, участвующие в реакции и находящиеся в растворе, будем условно заключать в квадратные скобки:
т
![]()
Металл и соединение MkmГn образуют раствор. Константа равновесия
такой реакции может быть записана в виде:

РГ2 в условиях равновесия при данной температуре является давлением диссоциации соединения MemГn, находящегося в растворе
![]()
-![]() активность химического соединения в
растворе
активность химического соединения в
растворе
![]() -
активность металла в растворе
-
активность металла в растворе
В данной системе металл Me является растворителем, а соединение MemГn растворимым веществом. При образовании ненасыщенных растворов MemГnB Me
![]()
![]()
При изотермическом процессе (Т =const) Kp=const)
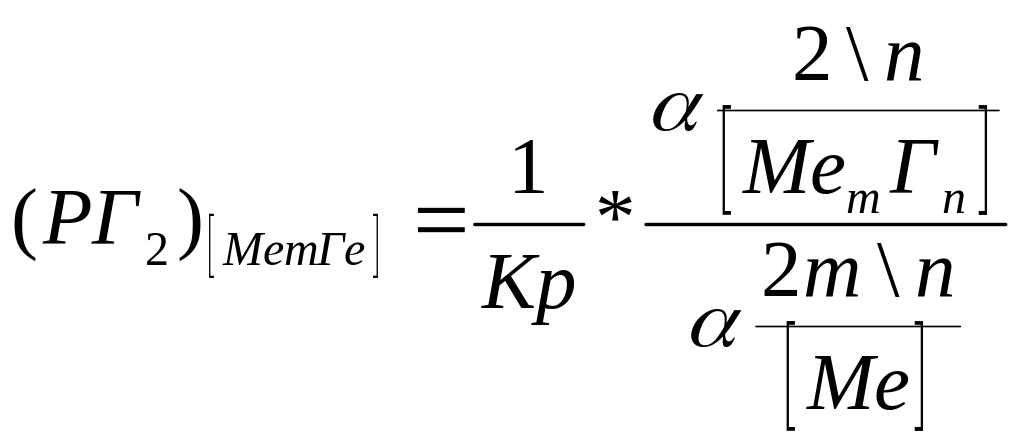
Поскольку при отсутствии растворения MemГn в Me, Или при условий образования насыщенных растворов aMem Гn=1 и aMe=1
![]()
Cледовательно:
![]()
Т.е
давление диссоциации соединения,
находящегося в ненасыщенном растворе
![]() равно
давлению диссоциации того же соединения
в насыщенном растворе (или свободном
виде)
умноженному на соотношение активностей
соединения и металла в ненасыщенном
растворе.
равно
давлению диссоциации того же соединения
в насыщенном растворе (или свободном
виде)
умноженному на соотношение активностей
соединения и металла в ненасыщенном
растворе.
Так
как растворы соединения а металле
являются сильно разбавленными, т.ев
концентрация растворенного вещества
очень мала, то с некоторым допущением
активность металлы
![]() растворе можно принять равной единице?
растворе можно принять равной единице?
![]()
Тогда:
![]()
Из уравнения следует, что по мере увеличения активности соединения в растворе диссоциации его увеличивается, а термодинамическая прочность понижается
Таким образом, расчёт давления диссоциации в данных условиях может быть сведён к расчёту давления диссоциации данного соединения в свободном виде при заданной температуре (по методике, рассмотренной при решении задач по теме УХ) и расчёту активности растворенного в металле соединения*
Расчет активности соединения в.растворе может быть проведен любым доступным способом.
Часто активность приходится находить опытным путём или по экспериментальным данным, опубликованным в литературе. В некоторых случаях активность можно представить как относительную концентрацию или как меру отключения концентрации данного раствора от насыщенной концентрации.

Если известна величина парциальной молярной свободной энергии растворения, то активность можно раcсчитывать по уравнению:

Известно,
что коэффициент активности
![]() показывает, насколько данный реальный
раствор отличается от идеального.
Поэтому
активность
может
быть выражена через
мольную
долю
:
показывает, насколько данный реальный
раствор отличается от идеального.
Поэтому
активность
может
быть выражена через
мольную
долю
:
![]() в
растворе и коэффициент активности
в
растворе и коэффициент активности
![]() :
:
![]()
Мольная доля растворенного вещества может быть рассчитана через концентрацию газа, входящего в соединение.

Где:
![]() -
процентное
содержание газа, растворенного в металле
-
процентное
содержание газа, растворенного в металле
Мг - молекулярный вес газа; атомный вес металла;
100 -[%Г] - процентное содержание металла в растворе.
Коэффициент активности может быть рассчитан через парциальную
теплоту растворения:
![]()
