
5. Фазові переходи 1 і 2-го роду. Загальна класифікація
В природі існують переходи однієї фази в іншу двох типів, які називаються фазовими переходами першого і другого роду:
- Фазові переходи першого роду характеризуються тим, що при них стрибком змінюється внутрішня енергія і густина речовини. До фазових переходів першого роду відносяться: кипіння рідини, конденсація пари, плавлення і випаровування твердих тіл, поліморфні перетворення (наприклад, ромбоедричної сірки в моноклінну).
Оскільки під час фазових переходів першого роду відбувається зміна внутрішньої енергії і питомого об’єму, ці перетворення завжди супроводжуються поглинанням або виділенням схованої теплоти перетворення.
З мікроскопічної точки зору, при фазових переходах 1-го роду атоми речовини переміщаються на великі відстані порядку розмірів параметрів ґратки. При цьому зміна симетрії ґратки відбувається стрибком.
- Фазові переходи другого роду характеризуються тим, що внутрішня енергія і густина речовини не змінюється. Однак стрибком змінюються інші параметри тіл: теплоємність, коефіцієнти стиснення і теплового розширення.
Схована теплота при таких фазових переходах відсутня. До фазових переходів другого роду відносяться перехід магнітних металів із феромагнітного стану в парамагнітний в точці Кюрі, перехід провідників з нормального у надпровідний стан, перехід сегнетоелектрика у діелектрик, перетворення рідкого гелію при Т = 2,13К в гелій ІІ при тиску 1 ат., який має властивості надтекучості.
З мікроскопічної точки зору, у фазових переходах другого роду відбувається незначне переміщення атомів, що не потребує великих витрат енергії. Однак такі переміщення змінюють симетрію кристала і в цьому суть цих переходів.
Рівняння Клапейрона-Клаузіуса
Основне рівняння, яке описує фазові переходи першого роду, є диференціальне рівняння Клапейрона-Клаузіуса. Його можна отримати із умови рівності хімічних потенціалів (питомих термодинамічних потенціалів) при рівновазі двох фаз
![]() .
(12)
.
(12)
Дане рівняння пов’язує між собою теплоту переходу, стрибок питомого об’єму і нахил кривої рівноваги в точці переходу.
Справді, вираз (12) може бути розв’язаний відносно тиску
р = р(Т) (13)
і в такій формі дає явний вигляд кривої рівноваги, наприклад, системи рідина-газ. Але в більшості випадків рівнянні рівноваги (13) не вдається записати в явному вигляді. Між тим, як виявилось, диференціальне рівняння кривої рівноваги має більш простий вигляд і пов’язує між собою вимірювані в досліді величини. Продиференцюємо вираз (13)
![]()
 .
.
П ригадавши,
що
ригадавши,
що
![]() ,
де s
і v
питомі ентропія та об’єм, отримаємо
,
де s
і v
питомі ентропія та об’єм, отримаємо
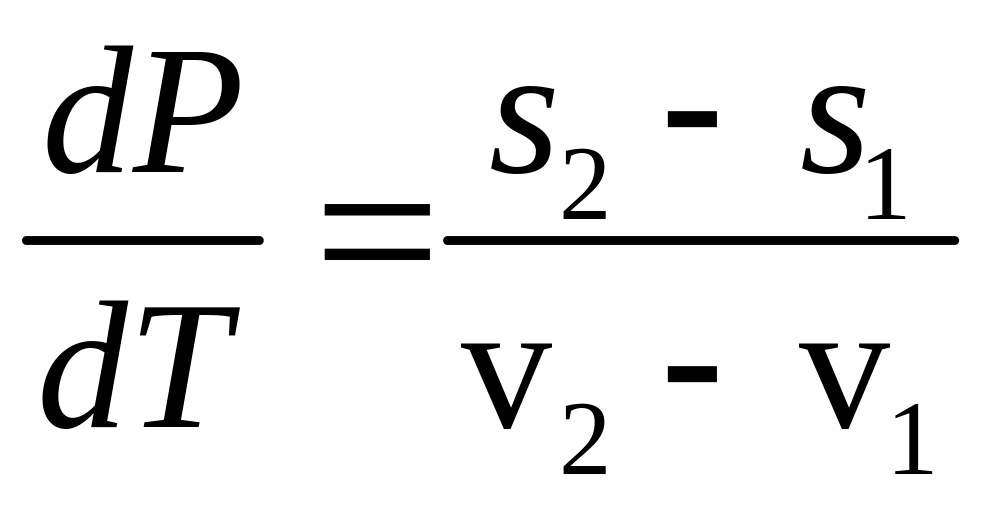 .
(14)
.
(14)
![]() -
нахил кривої рівноваги.
Рівняння
(14) – диференціальне рівняння кривої
рівноваги і має назву рівняння
Клапейрона-Клаузіуса.
-
нахил кривої рівноваги.
Рівняння
(14) – диференціальне рівняння кривої
рівноваги і має назву рівняння
Клапейрона-Клаузіуса.
Фазові перетворення 1-го роду супроводжуються стрибкоподібними змінами ентропії, тобто при таких перетвореннях поглинається або виділяється тепло. Так при переході одиниці маси з газової фази (стан 1) у рідку фазу (стан 2) виділяється кількість теплоти
![]() ,
,
а при оберненому переході така ж кількість
теплоти поглинається. Кількість теплоти
при оберненому переході така ж кількість
теплоти поглинається. Кількість теплоти
![]() називають
питомою
теплотою
випаровування.
В
загальному
випадку q
– питома
теплота фазового перетворення.
Рівняння (14) можна переписати у вигляді
називають
питомою
теплотою
випаровування.
В
загальному
випадку q
– питома
теплота фазового перетворення.
Рівняння (14) можна переписати у вигляді
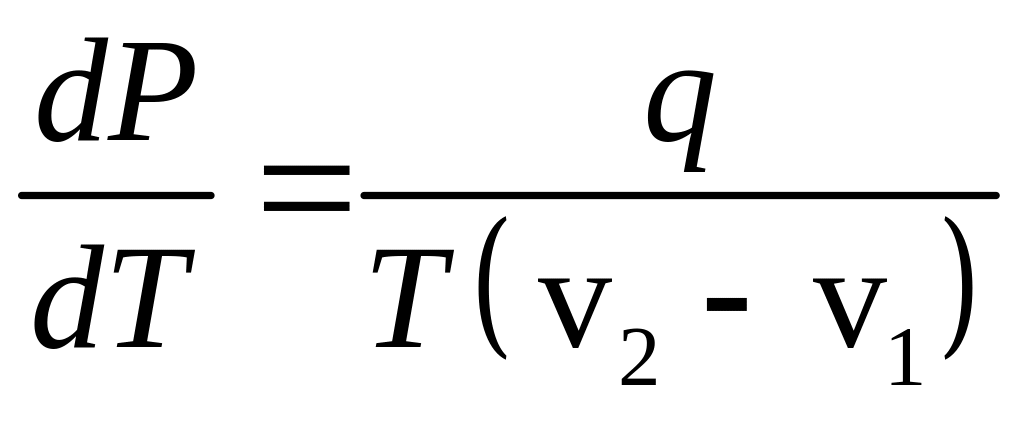 .
()
.
()
З допомогою цього рівняння можна розрахувати питомі теплоти випаровування, возгонки, плавлення та зміни модифікації.
Рівняння
Клапейрона-Клаузіуса
дозволяє визначати
зміну температури фазового переходу
(наприклад, точку кипіння або замерзання)
із зміною тиску. При позитивному знаку
схованої теплоти q,
знак похідної
![]() - визначається
зміною питомих об'ємів
(v2-v1).
Так при випаровуванні теплота надається
q
>
0 і об’єм збільшується (v2-v1)
> 0, то
> 0, і звідси температура випаровування
зростає
з
підвищенням тиску. Приклад: у горах, де
тиск менше, температура кипіння води
нижче 100° С.
- визначається
зміною питомих об'ємів
(v2-v1).
Так при випаровуванні теплота надається
q
>
0 і об’єм збільшується (v2-v1)
> 0, то
> 0, і звідси температура випаровування
зростає
з
підвищенням тиску. Приклад: у горах, де
тиск менше, температура кипіння води
нижче 100° С.
Подібна картина спостерігається і при плавленні, коли густина рідкої фази 1 менше густини твердої фази 2 і об'єм рідкого стану більший (v2-v1) > 0. При цьому зі збільшенням тиску температура плавлення також зростає. Це відбувається для більшості речовин. Однак, існує ряд речовин, у яких питомий об'єм в рідкому стані менший (густина більша), ніж у твердому стані. Найбільш розповсюджений приклад - вода і лід. Лід займає більший об'єм, і для переходу лід - вода одержуємо (v2-v1) < 0. Це означає, що при підвищенні тиску температура плавлення льоду зменшується.
Рівняння Еренфеста, які описують фазові переходи другого роду, можна подивитись в [3, 476-480]
