
- •Частина і. Загальна патологія
- •1. Предмет, завдання і методи патологічної фізіології. Патологічна фізіологія як навчальна дисципліна
- •2 Загальна нозологія
- •IV. За патогенезом:
- •I. Фізіологічний апоптоз відбувається:
- •II. Апоптоз в патологічних умовах може відбуватися:
- •I. Зменшення об'єму циркулюючої крові:
- •II. Зменшення хвилинного об'єму серця:
- •IV. Порушення реологічних властивостей крові:
- •I. Периферичні механізми:
- •II. Периферично-центральні механізми:
- •I. Свд може виявлятися:
- •II. Свд може характеризуватися:
IV. За патогенезом:
1) алергічні реакції гуморального типу (І, II і III типи реакцій за Кумбсом і Джеллом);
2) алергічні реакції клітинного типу (IV тип реакцій за Кумбсом і Джеллом).
10.9. Що таке алергічні реакції негайного й уповільненого типу?
Алергічні реакції негайного типу виникають відразу ж або через 15—20 хв. після контакту алергену із сенсибілізованим організмом. Такими реакціями є анафілактичний шок, бронхіальна астма, алергія на пилок рослин та ін.
Алергічні реакції уповільненого типу виявляють себе через 24-48 год. після контакту алергену із сенсибілізованим організмом. Прикладом таких реакцій можуть І бути туберкулінова проба, реакція відторгнення трансплантата.
10.10. Які стадії виділяють у патогенезі алергічних реакцій?
I. Імунологічна стадія.
II. Патохімічна стадія.
III. Патофізіологічна стадія (стадія клінічних проявів).
10.11. Який період часу охоплює імунологічна стадія алергічних реакцій ? У чому її сутність ?
Імунологічна стадія — це період часу від першого контакту алергену з організмом до взаємодії цього ж алергену, звичайно при повторному надходженні його в і організм, з ефекторами імунної системи (антитілами або Т-лімфоцитами). Сутність імунологічної стадії полягає в сенсибілізації організму.
10.12. Що таке сенсибілізація? Які існують її варіанти?
Сенсибілізація - це стан підвищеної чутливості організму до певного антигену, її основу становлять два послідовних процеси:
1) активація антигенспецифічних лімфоцитів, їх проліферація й утворення антитіл або сенсибілізованих Т-ефекторів;
2) розподіл антитіл або Т-ефекторів в організмі.
Сенсибілізація може бути активною і пасивною.
При активній організм самостійно утворює антитіла або сенсибілізовані Т-ефектори.
Пасивна сенсибілізація виникає тоді, коли в організм уводять ззовні специфічні до даного антигену готові антитіла або сенсибілізовані Т-ефектори.
10.13. У чому сутність патохімічної стадії алергічних реакцій?
Патохімічна стадія — це період часу від початку взаємодії алергену з ефектора→ ми імунної системи (антитілами або Т-лімфоцитами) до появи біологічно активних речовин — медіаторів алергічних реакцій.
Сутність цієї стадії полягає в утворенні, вивільненні або активації зазначених медіаторів.
10.14. Чим характеризується патофізіологічна стадія алергічних реакцій?
Патофізіологічна стадія — це період часу від початку дії медіаторів алергічних реакцій на клітинні й тканинні структури організму до появи клінічних ознак.
її сутність - розвиток комплексу структурних і функціональних порушень в І організмі.
10.15. У чому сутність алергічних реакцій І типу (анафілактичних) за класифікацією Кумбса іДжєлла?
Гуморальні антитіла фіксуються на поверхні клітин (головним чином тканинних базофілів), антиген перебуває у вільному стані. Реакція антиген-антиті-ло відбувається на поверхні цих клітин (рис. 26).
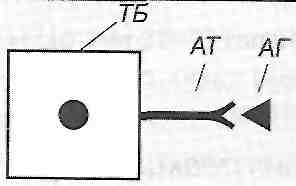
Рис. 26. Алергічні реакції І типу: ТЕ — тканинний базофіп; AT— антитіло; АГ - антиген
10.16. Що таке анафілаксія? Які існують її
ВИДИ?
Анафілаксія — це стан зниженої стійкості до дії антигену, що настає в результаті імунізації.
Відкрили це явище Портьє і Ріше в 1902 p., визначивши анафілаксію як стан підвищеної чутливості до повторного парентерального введення білка.
Сьогодні анафілаксію відносять до І типу алергічних реакцій за класифікацією Кумбса і Джелла.
Виділяють генералізовані (загальні) і місцеві анафілактичні реакції. До перших належить анафілактичний шок, до других - феномен Овері.
10.17. Як в експерименті можна відтворити анафілактичний шок?
Морській свинці внутрішньовенно вводять І О"6 мл (0,07 мкг білка) кінської сироватки (сенсибілізуюча доза). Через 10-21 добу внутрішньовенно вводять ту ж сироватку в дозі, у 10 разів вищій за попередню. Цю дозу називають завершальною. Через 10-15 хв. після повторного введення сироватки настає смерть від анафілактичного шоку, який у морських свинок виявляється головним чином спазмом бронхіол.
В інших видів тварин смерть настає в результаті спазму сфінктерів печінкових вен (собаки), спазму легеневих артерій (кролі), а у людини, як і у морських свинок, унаслідок генералізованого спазму бронхіол і розвитку гострої недостатності зовнішнього дихання.
10.18. Що таке феномен Овері? Як його відтворюють в експерименті?
Феномен Овері - це місцева анафілактична реакція. Існує два варіанти його відтворення: активний і пасивний.
Активний варіант. Сенсибілізованій морській свинці внутрішньо шкірно вводять завершальну дозу антигену разом з високомолекулярним барвником (синім Еванса). У результаті в місці введення антигену збільшується проникність судин шкіри і утворюється велика синя пляма.
Пасивний варіант. Несенсибілізованій морській свинці в шкіру вводять одночасно сироватку, що містить антитіла проти антигену, сам антиген і барвник (синій Еванса). Результат той самий.
10.19. Наведіть приклади клінічних форм алергічних реакцій І типу (анафілактичних).
Анафілактичний шок, бронхіальна астма, полінози (алергія на пилок рослин), кропив'янка, алергічний нежить, ангіоневротичний набряк (набряк Квінке).
10.20. Що відбувається під час імунологічної стадії алергічних реакцій І типу?
Антигени, здатні викликати алергічні реакції І типу, є тимусзалежними. Тому при першому надходженні їх в організм відбуваються такі процеси:
1) поглинання, переробка й презентація антигену макрофагами;
2) активація відповідних антигенспецифічних Т-хелперів;
3) активація клонів антигенспецифічних В-лімфоцитів, їх бласттрансформація й перетворення на плазматичні клітини;
4) утворення плазматичними клітинами цитофільних антитіл— реагінів. Реагіни представлені двома групами імуноглобулінів - IgE та IgG4;
5) поширення реагінів в організмі й фіксація їх на поверхні клітин, головним чином тканинних базофілів і базофілів крові.
Утворення реагінів і поширення їх в організмі з фіксацією на поверхні тканинних базофілів становлять сутність сенсибілізації організму до даного антигену. Мінімальна тривалість періоду сенсибілізації - 5-7 діб;
6) взаємодія антигену з фіксованими на поверхні клітин реагінами. Така реакція ан-тиген+антитіло відбувається при повторному надходженні антигену у вже сенсибілізований організм.
10.21. Чим характеризується патохімічна стадія алергічних реакцій
І типу?
Розрізняють класичний і додатковий механізми патохімічної стадії анафілактичних реакцій.
Сутність класичного механізму полягає в дегрануляції тканинних базофілів, на поверхні яких відбувається реакція антиген+антитіло. У результаті вивільнюються так звані первинні медіатори анафілактичних реакцій. Вони визначають хід подій у перші півгодини після повторного надходження антигену, тобто ранню фазу анафілактичної реакції.
У результаті дегрануляції тканинних базофілів у навкружну тканину виділяються:
а) гістамін (у деяких видів тварин, але не у людини, ще й серотонін);
б) гепарин;
в) повільно реагуюча субстанція анафілаксії (належить до лейкотрієнів);
г) фактор еміграції еозинофілів; ґ) фактор еміграції нейтрофілів;
д) фактор агрегації тромбоцитів;
є) ферменти (нейтральні й кислі протеази).
Значення продуктів дегрануляції тканинних базофілів полягає в тому, що вони безпосередньо діють на клітини-мішені (гладкі м'язи судин, бронхів, матки, кишок,
ендотеліоцити) і втягують в алергічну реакцію інші популяції клітин (еозинофіли, нейтрофіли, тромбоцити).
10.22. Яку дію має гістамін в умовах розвитку анафілактичних реакцій?
Ефекти гістаміну в тканинах пов'язані з Н,- і Н2-рецепторами. У низьких концентраціях гістамін стимулює в основному Ht-, у високих — Н2-рецептори.
Основні прояви анафілактичних реакцій зумовлені дією гістаміну на Н,-рецеп-тори. Унаслідок цього виникають такі зміни:
1) скорочення гладких м'язів бронхів, матки, кишок;
2) розширення артеріол;
3) підвищення проникності судинної стінки, в основному на рівні венул;
4) подразнення нервових закінчень (свербіж, біль);
5) збільшення утворення й виділення слизу у верхніх дихальних шляхах.
Дія гістаміну на Н2-рецептори, навпаки, викликає згасання анафілактичних реакцій. Цьому сприяє гальмування дальшої дегрануляції тканинних базофілів, пригнічення активності лімфоцитів, активація Т-супресорів.
10.23. Які існують механізми, що обмежують патохімічну стадію анафілактичних реакцій?
1. Активація гістаміном Н,-рецепторів (див. запит. 10.22).
2. Надходження в тканину еозинофілів, які вивільнюють інгібітор дегрануляції тканинних базофілів і ферменти (гістаміназу, арилсульфатазу, фосфоліпазу D), що руйнують первинні медіатори анафілактичних реакцій.
3. Гістамінопексія - зв'язування гістаміну білками сироватки крові.
10.24. У чому сутність додаткового механізму патохімічної стадії анафілактичних реакцій?
Цей механізм пов'язаний з активацією не тканинних базофілів, а інших клітин, що мають на своїй поверхні низькоафінні (з низькою спорідненістю) рецептори для фіксації реагінів. Це макрофаги, нейтрофіли, еозинофіли, тромбоцити. їхню активацію викликають великі завершальні дози антигену й продукти дегрануляції тканинних базофілів. Активовані клітини крові вивільнюють речовини, що отримали назву вторинних медіаторів анафілактичних реакцій. Вони обумовлюють розвиток пізньої фази реакцій І типу, ознаки якої виявляються через 6-12 год. і пов'язані з інфільтрацією тканин макрофагами, нейтрофілами й еозинофілами.
/ 0.25. Які місцеві клінічні прояви характерні для анафілактичних реакцій? Який механізм їхнього розвитку?
Місцеві прояви анафілактичних реакцій пов'язані з дією біологічно активних речовин - продуктів дегрануляції тканинних базофілів. Ці речовини викликають: а) спазм гладких м'язів бронхів - напади ядухи (бронхіальна астма). Розвиваються в результаті дії повільно реагуючої субстанції анафілаксії й гістаміну;
б) алергічний нежить, фарингіт, ларингіт, трахеїт. Ці прояви виникають як наслідок підвищеного утворення й виділення слизу у верхніх дихальних шляхах;
в) спазм гладкої мускулатури кишок - проноси (діарея); w..
г) розширення артеріол - почервоніння, алергічний висип на шкірі, кон 'юнктивіт; ґ) підвищення проникності стінок судин - розвиток місцевих набряків;
д) подразнення нервових закінчень - свербіж, біль.
10.26. Назвіть основні механізми розвитку клінічних проявів анафілактичного шоку.
Імунні й патохімічні механізми анафілактичних реакцій в кінцевому підсумку призводять до розвитку функціональних змін, які становлять сутність патофізіологічної стадії алергічної реакції, яка виявляє себе розвитком анафілактичного шоку (рис. 27).
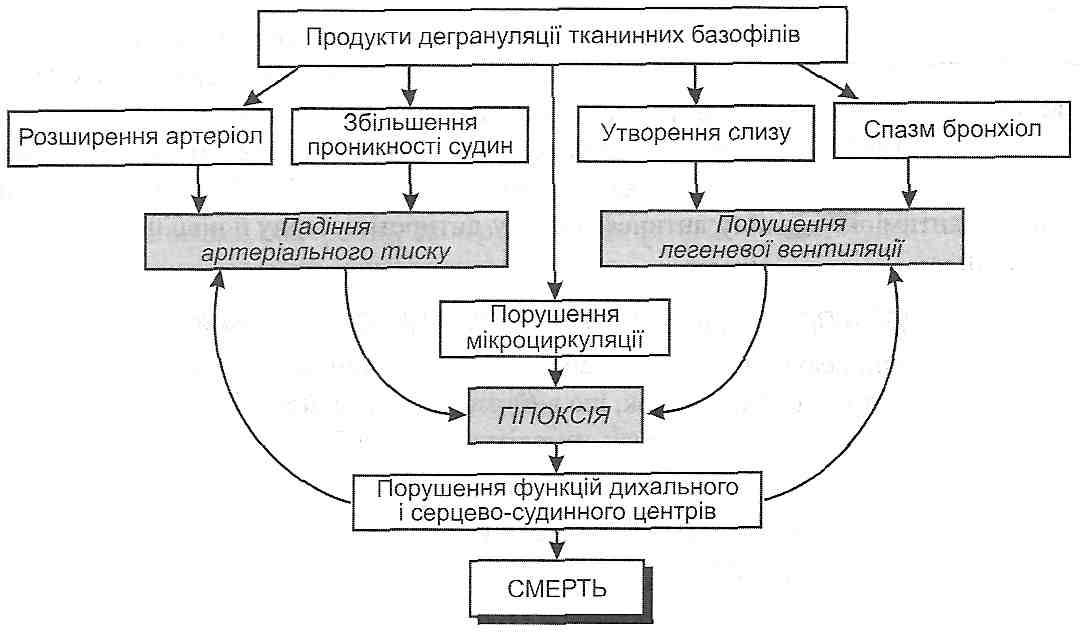
Рис. 27. Схема патогенезу анафілактичного шоку
Головними в цей період є такі процеси. І. Порушення загальної гемодинаміки, що виявляють себе насамперед падінням артеріального тиску. В основі цих порушень лежать:
а) генералізоване розширення артеріол і пов'язане з цим падіння загального периферичного опору;
б) генералізоване підвищення проникності судин, що призводить до виходу рідини з судин у тканини і зменшення об'єму циркулюючої крові.
її. Розлади мікроциркуляції. Виникають у результаті падіння артеріального тиску і згущення крові.
III. Розвиток гострої недостатності зовнішнього дихання внаслідок спазму бронхів і бронхіол та закупорки слизом повітроносних шляхів.
Усі зазначені процеси призводять до розвитку гострої гіпоксії, що викликає порушення функції дихального й серцево-судинного центрів і в кінцевому підсумку — смерть.
10.27. У чому сутність алергічних реакцій і І типу (цитотоксичних) за класифікацією Кумбса іДжелла?
Антигени перебувають на поверхні клітин, антитіла у вільному стані. Реакція антиген* антитіло відбувається на поверхні клітини (рис. 28).
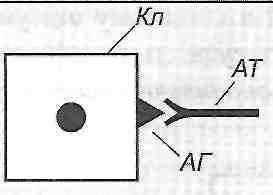
Рис. 28. Алергічні реакції її типу: Кл - клітина
10.28. Як в експерименті відтворюють цитотоксичні реакції?
З метою відтворення алергічних реакцій II типу використовують цитотоксичні сироватки, які містять антитіла проти антигенів тої чи тої тканини.
Такі сироватки отримують шляхом імунізації тварин тканинними антигенами. Подібним чином можна
отримати антиміокардіальну, антинефротичну, антиретикулярну й інші цитотоксичні сироватки.
10.29. Наведіть приклади клінічних форм цитотоксичних реакцій.
Цитотоксичні реакції виявляють себе такими клінічними формами: аутоалергіч-ні хвороби, гемотрансфузійний шок, що виникає при переливанні несумісної за групами АВО або резус-фактором крові; гемолітична хвороба новонароджених (рсзус-конфлікт); алергія на лікарські препарати.
10.30. Які антигени й антитіла беруть участь у розвитку цитотоксичних реакцій?
Антигени:
а) компоненти мембран власних клітин (незмінені і змінені під дією різних факторів);
б) вторинно фіксовані (адсорбовані) на клітинних мембранах антигени, наприклад, лікарські препарати;
в) неклітинні компоненти тканин (колаген, мієлін).
Антитіла: IgG]3 IgG2, IgG3. За походженням вони можуть бути природними (ізо-антитіла до антигенів груп крові) та імунними, тобто такими, які утворюються в організмі внаслідок контакту його з антигенами.
Для розвитку цитотоксичних реакцій мають значення такі властивості антитіл:
1) здатність зв'язувати комплемент;
2) ефект опсонізації;
3) здатність проникати у,тканини.
10.31. Які механізми забезпечують руйнування клітин (цитоліз) під час цитотоксичних реакцій?
виділяють такі механізми цитолізу (рис. 29).
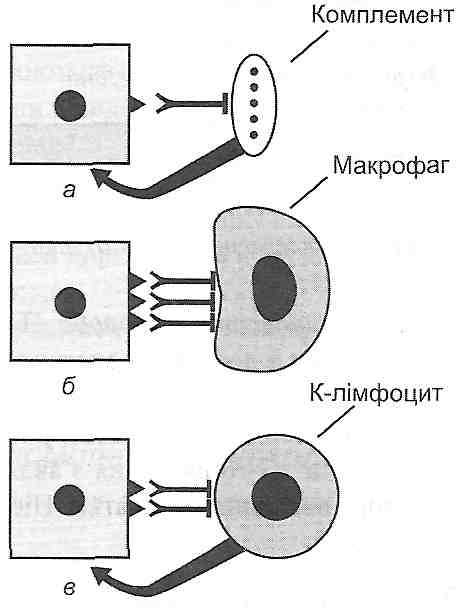
Рис. 29. Механізми цитолізу: а — комплементзалежний цитоліз; б — антитілозалежний фагоцитоз; в — антитілозалежна клітинна цитотоксичність
1. Комплементзалежний цитоліз. Після того як антитіла зв'язуються з антигеном на поверхні клітини, відбувається фіксація комплементу до Рс-фрагментів імуноглобулінів. У результаті активації комплементу мембрана клітини, що несе антиген, перфорується (у ній утворюються отвори) і клітина ушкоджується, а потім гине.
2. Антитілозалежний фагоцитоз. Зв'язані з антигенами антитіла викликають ефект опсонізації, тобто полегшують фагоцитоз клітини, що несе антигени, макрофагами (див. розд. 8).
3. Антитілозалежна клітинна цитотоксичність. Знищення клітини, що несе антигени, зв'язані з антитілами, може бути здійснене К-лімфоцитами (кілерами), які є різновидом О-лімфоцитів і мають рецептори до Рс-фраг-менту антитіл.
10.32. Чим характеризується патохімічна стадія цитотоксичних реакцій?
Для патохімічної стадії характерні:
1) активація комплементу й утворення проміжних (СЗЬ) і побічних (СЗа, С5а) продуктів його активації;
2) генерація вільних радикалів і пероксидів активованими макрофагами і К-лімфоцитами;
3) вивільнення макрофагами лізосомних ферментів.
10.33. Що відбувається під час патофізіологічної стадії цитотоксичних реакцій?
Активований комплемент, вільні радикали, пероксиди й лізосомні ферменти ушкоджують клітини і викликають їх загибель. Це у свою чергу є причиною розвитку запалення (див. розд. 14).
Якщо кількість антитіл, що реагують з антигеном, невелика і є недостатньою, щоб викликати ушкодження, то може спостерігатися ефект стимуляції функціональної активності клітин.
Цим, зокрема, обумовлені стимулююча дія невеликих доз антиретикулярної цитотоксичної сироватки (сироватки Богомольця) і розвиток аутоімунного тиреотоксикозу.
10.34. У чому сутність алергічних реакцій III типу (імунокомплексних) за класифікацією Кумбса іДжелла?
Антиген і антитіло перебувають у вільному стані (не фіксовані на поверхні клітин), їхня взаємодія відбувається в крові і тканинній рідині (рис. ЗО).
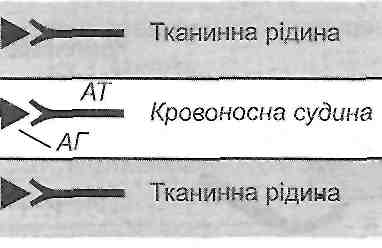
Рис. ЗО. Алергічні реакції III типу
10.35. Як відтворюють імунокомплексні реакції в експерименті?
При одноразовому введенні тварині великої дози чужорідної сироватки може роз-
виватися сироваткова хвороба. Перші її морфологічні й клінічні ознаки з'являються на 8-му добу й досягають максимуму на 12—14-ту добу після введення сироватки.
В експерименті можна моделювати й місцевий імунокомплексний процес - феномен Артюса. Кролям підшкірно з інтервалами в 5 діб уводять кінську сироватку. Починаючи з 3-го введення з'являється набряк, що збільшується після кожного наступного введення сироватки. Після 6-го введення виникає центральний геморагічний некроз.
10.36. Наведіть приклади клінічних форм імунокомплексних реакцій.
Імунокомплексні механізми мають значення в патогенезі таких груп недуг.
I. Хвороби, зумовлені екзогенними антигенами (сироваткова хвороба, деякі форми алергії на лікарські препарати, алергічний альвеоліт).
II. Аутоалергічні хвороби (системний червоний вовчак, ревматоїдний артрит, вузликовий періартеріїт, тиреоїдит Хашимото).
III. Інфекційні хвороби (гепатит В, стрептококові інфекції).
10.37. Які антигени й антитіла беруть участь у розвитку імунокомплексних реакцій?
Антигени, що викликають розвиток імунокомплексних реакцій, мають бути розчинними.
Антитіла - IgM, IgGp IgG2, IgG3 - мають властивість преципітації. При взаємодії з антигеном вони утворюють преципітати і здатні зв'язувати комплемент.
10.38. Які чинники визначають патогенні властивості циркулюючих імунних комплексів ?
Патогенні властивості циркулюючих імунних комплексів визначаються такими факторами:
а) структурними й функціональними властивостями комплексів антиген-антитіло, зокрема розмірами комплексів і структурою їхніх ґраток;
б) тривалістю циркуляції імунних комплексів в організмі;
в) місцем утворення комплексів.
10.39. Які існують види циркулюючих імунних комплексів? Яке їх значення у розвитку алергічних реакцій ?
Види імунних комплексів:
а) великі комплекси, що утворюються в надлишку антитіл. Вони швидко видаляються з крові, що циркулює, макрофагами, а тому не чинять патогенної дії;
б) преципітовапі, нерозчинні комплекси, що утворюються в еквівалентних співвідношеннях антигену й антитіл. Як і попередні, вони швидко видаляються із крові і тому ушкодження не викликають. Виняток складають випадки, коли такі комплекси утворюються на фільтруючій мембрані, наприклад у клубочках нирок;
в) невеликі розчинні комплекси, які утворюються у великому надлишку антигену або у випадку одновалентних антигенів. Такі комплекси циркулюють в організмі тривалий час, але мають слабку ушкоджувальну дію;
г) розчинні комплекси проміжної величини. Вони утворюються в невеликому надлишку антигену. їхня середня молекулярна маса становить 900 тис. — 1 млн. даль-тонів. Саме ці комплекси є причиною розвитку алергічних реакцій III типу.
10.40. Які умови сприяють розвитку імунокомплексних ушкоджень?
У нормі елімінація (видалення) імунних комплексів здійснюється за участю комплементу й макрофагів.
З огляду на це, розвитку імунокомплексних ушкоджень сприяють:
1) порушення системи комплементу;
2) функціональні дефекти системи мононуклеарних фагоцитів;
3) умови, при яких швидкість утворення імунних комплексів значно перевищує швидкість їх елімінації.
10.41. Чим характеризується патохімічна стадія імунокомплексних реакцій?
У патохімічній стадії реакцій III типу мають значення дві групи процесів.
I. Активація біохімічних систем плазми крові:
а) системи комплементу;
б) калікреїн-кінінової системи;
в) системи зсідання крові. Активація двох останніх пов'язана з ушкодженням імунними комплексами судинної стінки, що призводить до активації фактора Хагемана (ф. ХП).
II. Вивільнення активованими макрофагами:
а) лізосомних ферментів;
б) основних катіонних білків;
в) вільних радикалів і пероксидів.
10.42. Що відбувається під час патофізіологічно)' стадії алергічних реакцій III типу?
1. Місцеві зміни. Імунні комплекси відкладаються на поверхні ендотелію, на базальних мембранах судин, у тканинах. У результаті активації комплементу й дії
продуктів, що їх секретують макрофаги, відбувається ушкодження клітин і розвивається запалення (див. розд. 14). Найчастіше воно виникає в клубочках нирок (гломерулонефрит), легень (альвеоліт), судинній стінці (васкуліт). Крім того, утворення преципітатів безпосередньо в капілярах викликає первинні порушення мікроциркуляції і розвиток некротичних змін у тканинах. 2. Загальні зміни. Активація біохімічних систем крові може бути причиною дисемі-ноеаного внутрішньосудинного зсідання крові (ДВЗ-синдрому) (див. розд. 26). Крім того, прикріплення імунних комплексів через F -рецептори до поверхні формених елементів крові (нейтрофілів, тромбоцитів) викликає поглинання й руйнування останніх макрофагами. У результаті розвивається цитопенія (лейкопенія, тром боцитопенія).
10.43. У чому сутність алергічних реакцій IV типу (гіперчутливість уповільненого типу) за класифікацією Кумбса іДжелла?
З клітинами, що несуть на своїй поверхні антиген, взаємодіють Т-лімфоцити, що мають специфічні до даного антигену рецептори (рис. 31).
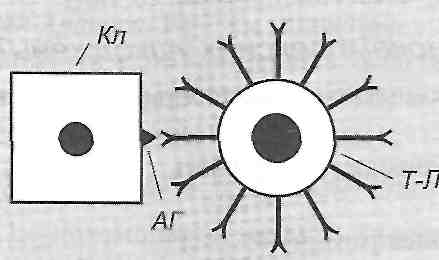
Рис. 31. Алергічні реакції IVтипу: Кл - клітина; Т-Л- Т-лімфоцит
10.44. Як відтворюють гіперчутливість уповільненого типу в експерименті?
Гіперчутливість уповільненого типу можна моделювати:
а) введенням тваринам убитих вакцин або антигенних екстрактів бактеріальних клітин разом з ад'ювантом Фрейнда;
б) введенням внутрішньошкірно мінімальних доз антигену.
10.45. Наведіть приклади клінічних форм гіпєрчутливості уповільненого типу.
Туберкулінова реакція, бактеріальна алергія, контактний дерматит, реакція відторгнення трансплантата, аутоалергічні хвороби, реакції протипухлинного імунітету.
10.46. У чому сутність імунологічної стадії алергічних реакцій IV типу?
Під час імунологічної стадії цього типу реакцій відбувається сенсибілізація організму, в основі якої - утворення клону Т-лімфоцитів, що мають на своїй поверхні специфічні рецептори до даного антигену.
Якщо утворення таких "сенсибілізованих" Т-лімфоцитів відбувається в самому організмі, то говорять про активну сенсибілізацію. Введення в організм готових Т-лімфоцитів, що мають специфічні рецептори до даного антигену, викликає стан пасивної сенсибілізації.
10.47. Які біологічно активні речовини виділяються під час патохімічної стадії алергічних реакцій IV типу?
Високомолекулярні речовини білкового і глікопротеїдного походження, що продукуються Т-лімфоцитами, — лімфокіни.
10.48. Як класифікують лімфокіни?
За механізмом дії виділяють:
1) лімфокіни, що ушкоджують клітини-мішені (цитотоксини);
2) лімфокіни, що викликають проліферацію клітин (мітогенні фактори);
3) лімфокіни, що впливають на міграцію різних типів клітин (хемотаксини).
За характером впливу на клітини-мішені лімфокіни можуть бути такими, що активують, і такими, що пригнічують.
Клітинами-мішенями для лімфокінів є різні популяції лімфоцитів, макрофаги, гранулоцити, свої й чужорідні клітини тканин. Є лімфокіни, які викликають і загальні реакції організму.
Приклади лімфокінів: інтерлейкін-2, фактор переносу Лоуренса, фактор бласт-трансформації, міграцієінгібуючий фактор (МІФ), фактор активації макрофагів (МАФ), інтерферон.
10.49. Які механізми забезпечують знищення клітин, що несуть антигени, у реакціях гіперчутливості уповільненого типу?
1. Пряма цитотоксичність Т-кі-лерів— знищення клітини, що несе антигени, безпосередньо Т-кілерами, які мають на своїй поверхні специфічні рецептори до антигенів цієї клітини.
2. Опосередкована лімфокінами цитотоксичність. Забезпечується лімфокінами: лімфоцито-токсинами, цитотоксичним фактором та ін.
3. Опосередкована макрофагами цитотоксичність. Сенсибілізовані Т-лімфоцити виділяють лімфокіни, які активують макрофаги (специфічно-армуючий фактор), викликають їхній хемотаксис (фактор хемотаксису, фактор активації макрофагів), затримують фагоцитів у вогнищі зосередження клітин, що несуть антигени, (міграцієінгібуючий фактор). Активовані макрофаги фагоцитують виявлені імунною системою чужорідні і свої змінені клітини (рис. 32).
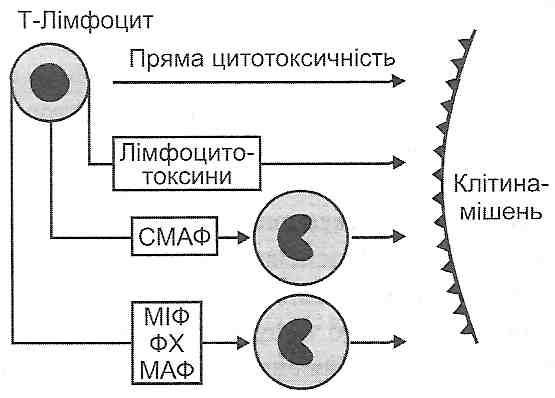
Рис. 32. Фактори клітинної цитотоксичності:
СМАФ - специфічно-макрофаг-армуючий фактор;
МІФ — міграцієінгібуючий фактор;
ФХ- фактор хемотаксису;
МАФ — макрофаг-активуючий фактор.
70.50. Що таке аутоалергічні реакції?
Аутоолергічиі реакції - це реакції, причиною яких є власні антигени (ендоалер-гсни) (див. запит. 10.5.).
їх патогенез містить у собі механізми розвитку алергічних реакцій II і IV типів за класифікацією Кумбса і Джелла.
10.51. Які механізми лежать в основі розвитку аутоалерп'ї?
I. Механізми, пов 'язані з антигенами:
1) демаскування природних ендоалергенів (порушення цілісності спеціалізованих гістогематичних бар'єрів);
2) утворення набутих ендоалергенів (дія факторів, що змінюють конформацію власних білків).
II. Механізми, пов'язані з імунною системою:
1) скасування імунологічної толерантності до нормальних компонентів клітин (наприклад, порушення Т-супресорів);
2) поява в результаті мутації "заборонених" клонів лімфоцитів, що сприймають "своє" як "чуже".
70.52. Що таке псевдоалергічні реакції? Наведіть приклади. Псевдошіергічні - це реакції, що мають зовнішні клінічні ознаки алергічних, але
не є такими, оскільки в їх основі лежать не імунні механізми (немає імунологічної стадії).
Реакції, подібні алергії, викликають хімічні фактори (лібератори гістаміну), що безпосередньо діють на тканинні базофіли й викликають їх дегрануляцію; порушен-. ня системи комплементу (дефіцит інгібіторів його компонентів, неімунна активація); порушення метаболізму поліненасичених жирових кислот, зокрема арахідонової (ас-піринова бронхіальна астма).
Прикладами експериментального відтворення псевд о алергічних реакцій є феномен Шварцмана (місцева реакція) і феномен Санарєллі (загальна реакція).
Феномен Шварцмана викликають введенням у шкіру тварин фільтрату культури збудника черевного тифу. Через добу фільтрат уводять внутрішньовенно й на місці первинного введення спостерігають геморагічне запалення.
Феномен Санарєллі відтворюють при внутрішньовенному введенні нелегальної дози ендотоксину холерних вібріонів, а через добу - фільтрату культури кишкової палички. Розвивається важка загальна реакція за типом шоку.
70.53. Назвіть основні принципи попередження й лікування алергії.
I. Запобігання контакту організму з алергенами (етіологічний принцип).
II. Попередження сенсибілізації, коли контакт організму з алергеном неминучий: створення імунологічної толерантності до даного антигену або стану імунологічної супресії, якщо перше неможливо.
III. Десенсибілізація. Одним з методів є введення антигену в сенсибілізований організм дробовими дозами з метою поступового зв'язування антитіл (метод Бсзредки).
; IV. Вплив на патохімічну стадію алергічних реакцій: попередження утворення і вивільнення медіаторів алергії, їхня інактивація (наприклад, антигістамінними препаратами); блокада рецепторів до медіаторів алергічних реакцій на клітинах-мішенях. V. Впливи на патофізіологічну стадію. Вони спрямовані на ліквідацію структурних і функціональних змін, що виникають при алергії. Це досягають застосуванням протизапальних, спазмолітичних, гіпертензивних та інших фармакологічних засобів.
11. Ушкодження клітини
11.1. Що таке ушкодження клітини і які існують принципи його класифікації?
Ушкодження клітини — це типовий патологічний процес, основу якого становлять зміни внутрішньоклітинного гомеостазу, що призводять до порушення структурної цілісності клітини і її функціональних властивостей.
Залежно від швидкості розвитку й вираженості основних проявів ушкодження клітини може бути гострим і хронічним, залежно від ступеня змін внутрішньоклітинного гомеостазу — оборотним і необоротним, залежно від періоду життєвого циклу, на який припадає дія ушкоджувального агента, - мітотичним та інтєрфазним, залежно від патогенетичних механізмів ініціювання ушкодження - насильницьким і цитопатичним.
11.2. Які чинники можуть викликати ушкодження клітини?
Безпосереднє (первинне) ушкодження клітини виникає в результаті прямої дії факторів:
1) фізичної природи (механічний вплив, висока й низька температури, іонізуюче випромінювання та ін.);
2) хімічного походження (кислоти, луги, низькомолекулярні органічні сполуки, ферменти та ін.);
3) біологічної природи (віруси, бактерії, найпростіші).
Опосередковане (вторинне) ушкодження виникає як наслідок первинних порушень сталості внутрішнього середовища організму (гіпоксія, ацидоз і алкалоз, гіпер-і гіпоосмія, гіпоглікемія та ін.).
11.3. Які ознаки свідчать про ушкодження клітини?
Про ушкодження клітини свідчать такі ознаки:
1. Структурні. їх виявляють за допомогою гістологічних і електронномікроскопіч-них методів дослідження, вони є предметом вивчення патологічної анатомії.
2. Функціональні. До них відносять: порушення електрофізіологічних процесів (деполяризація плазматичної мембрани, зміни властивостей збудливості й провідності, розвиток парабіозу); розлади скоротливості, екзо- і ендоцитозу; порушення клітинного поділу, міжклітинних контактів і взаємодій; зміни у сприйнятті клітиною нервових і гуморальних регуляторних впливів.
3. Фізично-хімічні, які охоплюють: а) порушення з боку клітинних колоїдів (зменшення ступеня дисперсності колоїдів цитоплазми і ядра, підвищення в'язкості цитоплазми, зміна сорбційних властивостей стосовно вітальних барвників) і б) зміни водно-електролітного обміну (збільшення концентрації в цитоплазмі
іонів натрію та кальцію і зменшення концентрації іонів калію, набряк клітини і окремих її органел, накопичення іонів водню — ацидоз ушкодження).
4. Біохімічні:
1) зменшення концентрації високоенергетичних сполук— креатинфосфату і АТФ - і збільшення концентрації продуктів їх гідролітичного розщеплення — креатину, АДФ, АМФ, неорганічного фосфату;
2) пригнічення тканинного дихання;
3) роз'єднання окиснення й фосфорування;
4) активація гліколізу;
5) активація процесів протеолізу;
6) збільшення інтенсивності процесів дезамінування.
5. Термодинамічні. Це декомпартменталізація, тобто порушення відносної відособленості внутрішньоклітинних відсіків; конформаційні зміни макромолекул, що відбуваються в напрямку найбільш вигідного термодинамічного стану (денатурація); розпад великих, складних молекул на дрібні, простіші; вирівнювання концентраційних градієнтів як між клітинними відсіками, так і між клітиною та позаклітинним середовищем.
11.4. Чим принципово відрізняються два патогенетичних варіанти ушкодження клітини: насильницький і цитопатичний?
Насильницьке ушкодження розвивається при дії на здорову клітину фізичних, хімічних і біологічних факторів, інтенсивність яких перевищує звичайні збуджувальні впливи, до яких клітина адаптована.
Цитопатичний варіант виникає в результаті первинного порушення захисно-компенсаторних гомеостатичних механізмів клітини. У цьому випадку факторами, що запускають патогенетичні механізми ушкодження, є природні для даної клітини збуджувальні стимули, які в цих умовах стають ушкоджувальними. До цитопа-тичного варіанта відносять усі види ушкодження клітини, спричинені відсутністю яких-небудь необхідних для неї компонентів (при гіпоксії, голодуванні, гіпо- і авітамінозах, антиоксидантній недостатності, генетичних дефектах, порушеннях нервової трофіки та ін.).
11.5. Які зміни на молекулярному рівні мають велике значення в патогенезі ушкодження клітини? *
Можна виділити 6 груп молекулярних механізмів, що відіграють важливу роль у патогенезі ушкодження клітин: ліпідні (пероксидне окиснення ліпідів, активація мембранних фосфоліпаз, детергентна дія вільних жирових кислот), кальцієві, електролітно-осмотичні, ацидотичні, протеїнові і нуклеїнові.
11.6. У чому сутність пероксидного окиснення ліпідів?
Пероксидним окисненням ліпідів (ПОЛ) називають вільнорадикальне окиснення ненасичених жирових кислот, що входять до складу фосфоліпідів клітинних мембран.
Ініціаторами ПОЛ є вільні радикали, серед яких найбільше значення мають: 'О " (Н02") - супероксидний радикал; ОН' - гідроксильний радикал; Н' - водневий радикал; *02 - синглетний (збуджений) кисень.
11. 7. Які реакції лежать в основі ініціювання пероксидного окиснемня ліпідів?
Первинний вільний радикал, що з'явився в клітині (А') взаємодіє з молекулою ненасиченої жирової кислоти (RH), у результаті чого утворюється вільний радикал цієї кислоти (R') і молекулярний продукт реакції (НА):
![]()
Вільний радикал жирової кислоти, що утворився, взаємодіє з молекулярним киснем, який завжди міститься в клітині, у результаті чого з'являється пероксидний радикал цієї кислоти (ROO'):
![]()
Пероксидний радикал, у свою чергу, вступає у взаємодію з новою молекулою ненасиченої жирової кислоти, що міститься поруч. У ході цієї реакції утворюється гідропероксид (ROOH) і новий вільний радикал:
![]()
Слід зазначити дві важливі особливості ПОЛ. Перша полягає в тому, що реакції ПОЛ мають ланцюговий характер. Це означає, що в ході реакцій ПОЛ не відбувається знищення вільних радикалів і в процес утягуються все нові й нові молекули нена-сичених жирових кислот.
Друга особливість- це розгалужений характер ПОЛ. Інакше кажучи, у реакціях ПОЛ у кількості, що наростає, з'являються вільні радикали, джерелом яких є самі проміжні продукти ПОЛ. Прикладом може бути утворення вільних радикалів з гідропероксидів ліпідів при їхній взаємодії з наявними в клітині металами змінної валентності:
![]()
Через те що в багатьох біохімічних реакціях за умов норми утворюється невелика кількість вільних радикалів, існує постійна небезпека активації ПОЛ в клітині. Однак у природних умовах цього не відбувається, оскільки клітина має у своєму розпорядженні механізми антиоксидантного захисту, завдяки яким досягається інактивація вільних радикалів, обмеження й гальмування ПОЛ.
11.8. Які антиоксидантні системи є в клітинах?
І. Ферментні антиоксидантні системи: 1. Супероксгіддисмутазна.
Компоненти: супероксиддисмутаза (СОД), каталаза. Призначення: інактивація супероксидних радикалів (HOj):
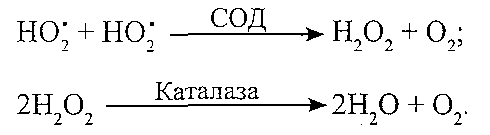
Причини порушень: набуті розлади синтезу ферментів, дефіцит міді і заліза. 2. Глютатіонова.
Компоненти: глютатіон (Г), глютатіонпероксидаза (ГП), глютатіонредуктаза (ГР), НАДФ-Н2.
Призначення: інактивація і руйнування гідропероксидів ліпідів:
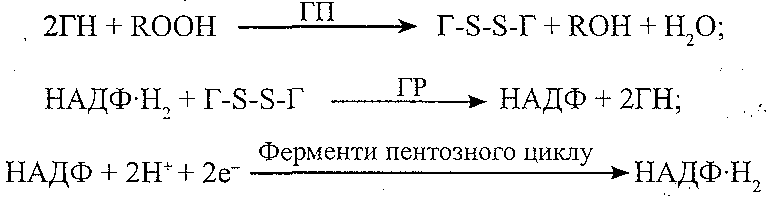
Причини порушень: спадково обумовлені і набуті порушення синтезу ферментів, дефіцит селену, порушення пентозного циклу (зменшення утворення НАДФН2).
II. Неферментні антиоксиданти: 1. "Істинні" антиоксиданти.
Компоненти: токофероли, убіхінони, нафтохінони, флавоноїди, стероїдні гормони, біогенні аміни.
Призначення: інактивація вільних радикалів жирових кислот:
![]()
де In — антиоксидант; In' — вільний радикал цього антиоксиданту, що має низьку реакційну здатність.
Причини порушень: гіповітаміноз Е, порушення регенерації "істинних" антиоксидантів. 2. Допоміжні антиоксиданти.
Компоненти: аскорбінова кислота, сполуки, що містять сірку - глютатіон, цистин, цистеїн.
Призначення: регенерація "істинних" антиоксидантів:
![]()
де DH - відновлена, D — окиснена форма допоміжного антиоксиданту.
Причини порушень: гіповітаміноз С, порушення пентозного циклу, дефіцит сполук, що містять сірку.
11.9. У яких випадках відбувається активація ПОЛ? Активація ПОЛ відбувається:
1) при надмірному утворенні первинних вільних радикалів (ультрафіолетове й іонізуюче випромінювання, гіпероксІя, отруєння чотирихлористим вуглецем, гіпервітаміноз D та ін.);
2) при порушенні функціонування антиоксидантних систем (недостатність ферментів - супероксиддисмутази, каталази, глютатіон пер оксид ази, глютатіонредуктази; дефіцит міді, заліза, селену; гіповітамінози Е, С; порушення пентозного циклу).
11.10. Які механізми лежать в основі порушень бар'єрних функцій клітинних мембран при активації ПОЛ?
I. Іонофорнш механізм обумовлений появою в клітині речовин, що мають властивості іонофорів, тобто сполук, здатних полегшувати дифузію іонів через мембрану завдяки утворенню комплексів, що проходять через її шари. У процесі активації ПОЛ серед проміжних продуктів його реакцій з'являються речовини-іонофори для іонів кальцію і водню. У результаті цього підвищується проникність клітинних мембран до цих іонів.
II. Механізм електричного пробою пов'язаний з існуванням на багатьох мембранах (плазматичній, внутрішній мітохондріальній) різниці потенціалів. У результаті появи гідрофільних продуктів ПОЛ порушуються електроізоляційні властивості гідрофобного шару клітинних мембран, що призводтггь до електричного пробою мембрани, тобто до електромеханічного її розриву з утворенням нових трансмембранних каналів іонної провідності.
11.11. Як порушується матрична функція мембран у процесі активації ПОЛ?
Сутність матричної функції ліпідного подвійного шару мембран полягає в тому, що в ньому вмонтовані мембранні ферменти та деякі спеціалізовані білки.
У процесі ПОЛ порушується активність мембранних ферментів, оскільки змінюється їх ліпідне мікрооточення, яке багато в чому визначає властивості білкових молекул. Крім того, у ході реакцій ПОЛ відбувається утворення "зшивок" між молекулами білків і фосфоліпідів, а також окиснення сульфгідрильних груп активних центрів, що призводить до необоротної інактивації ферментів.
11.12. Яким чином підвищення активності фосфоліпаз впливає на ушкодження клітинних мембран?
У патогенезі ушкодження клітини велике значення має надмірна активація фос-фоліпази А2 - ферменту, що здійснює гідролітичне відщеплення ненасичених жирових кислот від молекул фосфоліпідів клітинних мембран (рис. 33). У результаті цього утворюються лізофосфоліпіди, в молекулах яких лише один жировокислотний "хвіст", у зв'язку з чим вони мають здатність до міцелоутворення і є дуже сильними
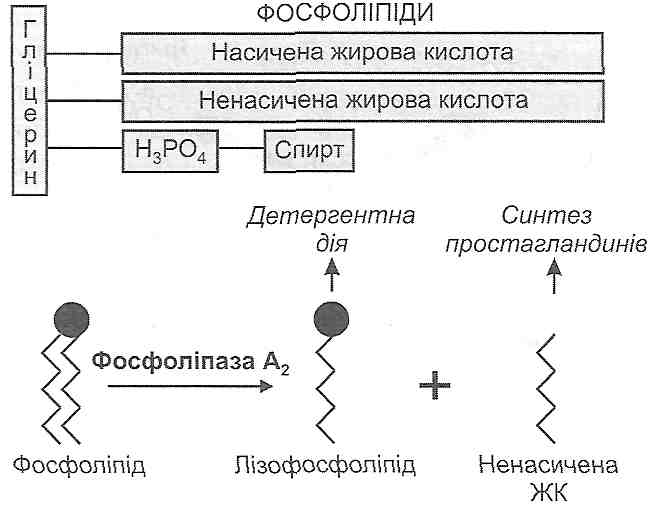
Рис. 33. Утворення лізофосфоліпідів
детергентами (рис. 34). З детергентною дією лізофосфоліпідів і пов'язане ушкодження клітинних мембран в умовах надмірної активації фосфоліпази А,, яку, як правило, викликають високі концентрації іонів кальцію в цитоплазмі клітини.
11.13. За яких умов виникає небезпека детергентноїдії вільних жирових кислот на клітинні мембрани?
Детергентна дія вільних жирових кислот (ВЖК) виявляється при збільшенні їхнього вмісту в клітині. Це може бути обумовлене (оис. 35):
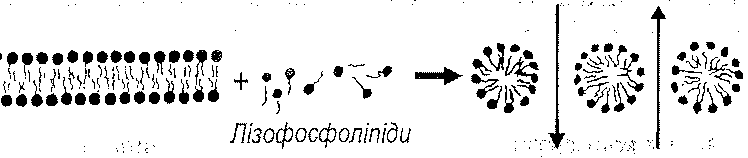
Рис. 34. Підвищення проникності клітинних мембран внаслідок детергентної дії лізофосфоліпідів
а) посиленим надходженням ВЖК у клітину при гіперліпацидемії (наприклад, активація ліполізу в жировій тканині при стресі, цукровому діабеті);
б) вивільненням ВЖК у лізосомах із тригліцеридної частини ліпопротеїдів, що надійшли в клітину із плазми крові (наприклад, гіперліпопротеїнемія при атеросклерозі);
в) вивільненням ВЖК із фосфоліпідів мембран під дією мембранних фосфоліпаз;
г) порушеннями використання ВЖК як джерела енергії (зменшення активності ферментів Р-окиснення і циклу Кребса, наприклад, при гіпоксії).
Для того щоб запобігти ушкоджувальній дії надлишку жирових кислот, клітина має у своєму розпорядженні систему ферментів, які переводять вільні жирові кис-
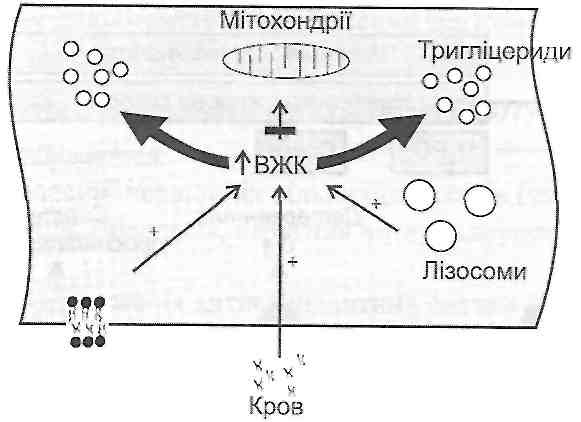
Рис. 35. Причини накопичення вільних жирових кислот (ВЖК) у клітині
лоти у форму триглщеридів. При цьому відбувається невластиве для норми відкладення тригліцеридів у вигляді жирових крапель, тобто виникає жирова дистрофія клітини.
11.14. У яких випадках іони кальцію втягуються в патогенез ушкодження клітини? З якими ефектами цих іонів пов 'язана їхня участь в ушкодженні клітинних структур?
Ушкодження клітинних структур може бути обумовлене стійким підвищенням концентрації іонів Са2+ у цитоплазмі клітини. Така ситуація виникає або в результаті надмірного надходження іонів Са2+ у цитоплазму (гіперкальціємія, підвищення проникності плазматичної мембрани), або в результаті порушення механізмів, що забезпечують видалення іонів Са2+ із цитоплазми (порушення Са-насосів, Na-Ca-об-мінного механізму, Са-акумулгоючої функції мітохондрій).
Підвищення концентрації іонів Са2т у цитоплазмі викликає:
а) контрактуру (пер є скорочення) фібрилярних структур клітини (міофібрил, елементів цитоскєлета);
б) активацію фосфоліпази А,;
в) роз'єднання процесів окиснення й фосфорування.
11. 15. Чим можуть бути обумовлені зміни вмісту іонів натрію й калію в клітині і яка роль таких порушень у патогенезі клітинного ушкодження?
Вирівнювання концентрацій іонів Na+ і К + по обидва боки плазматичної мембрани (збільшення вмісту Na+ і зменшення вмісту К+ у цитоплазмі) у своїй основі може мати два механізми: 1) посилену дифузію іонів через плазматичну мембрану за існуючим концентраційним і електричним градієнтом і 2) порушення механізмів активного транспорту Na+ і К+ (Na-K-насоса).
Перший механізм реалізується в умовах загальних порушень водно-електролітного обміну (гіпернатріємія, гіпокаліємія) і порушень бар'єрної функції плазматичної мембрани (підвищення її іонної проникності).
Розлади функції Na-K-насоса можуть бути обумовлені дефіцитом АТФ у клітині, збільшенням вмісту холестеролу в ліпідному бішарі мембрани (наприклад, при атеросклерозі), дією цілої низки специфічних інгібіторів Na-K-АТФ-ази (наприклад, строфантину).
Зміни вмісту іонів Na+ і К+ викликають:
а) втрату клітиною електричного мембранного потенціалу (потенціалу спокою), а отже і збудливості;
б) набряк клітини;
в) осмотичне розтягнення клітинних мембран, що супроводжується підвищенням їх проникності.
11. 16. Чим може бути обумовлений розвиток внутрішньоклітинного ацидозу і які зміни в клітині можуть бути з ним пов 'язані?
До розвитку внутрішньоклітинного ацидозу можуть спричинятися:
1) надмірне надходження іонів Н+ у клітину з позаклітинного середовища (декомпенсований газовий або негазовий ацидоз);
2) надмірне утворення кислих продуктів у самій клітині при активації гліколізу (молочна кислота), порушеннях циклу Кребса (три- і дикарбонові кислоти), гідролітичному розщепленні фосфоліпідів клітинних мембран (вільні жирові кислоти, фосфорна кислота) та ін.;
3) порушення зв'язування вільних іонів Н+ у результаті недостатності буферних систем клітини;
4) порушення виведення іонів Н+ з клітини при розладах Na-H-обмінного механізму, а також в умовах порушеного місцевого кровообігу в тканині.
Внутрішньоклітинний ацидоз викликає: а) зміну конформації білкових молекул з порушенням їх ферментативних, скоротливих та інших властивостей; б) підвищення проникності клітинних мембран; в) активацію лізосомних гідролітичних ферментів.
11.17. Які зміни білкових молекул мають значення в патогенезі ушкодження клітини?
До білкових (протеїнових) механізмів ушкодження клітини можна віднести:
1) інгібуванння ферментів (оборотне і необоротне);
2) денатурацію, тобто порушення нативної будови білкових молекул у результаті обумовлених розривом ковалентних зв'язків змін вторинної й третинної структур білка;
3) протеоліз, що здійснюється під дією лізосомних протеолітичних ферментів (ка-тепсинів) і протеаз, які активуються іонами Са2+, У результаті протеолізу можуть з'являтися пептиди, що мають властивості фізіологічно активних речовин. З виходом останніх з ушкоджених клітин може бути пов'язаний розвиток як місцевих, так і загальних реакцій організму (запалення, гарячка).
11. 18. Які порушення функціонування генетичного апарату клітини можуть призводити до її ушкодження?
Основу ушкодження клітини можуть становити так звані нуклеїнові механізми, обумовлені порушеннями процесів:
1) реплікації ДНК (денатурація ДНК, ушкодження ДНК-репліказної ферментної системи, дефіцит трифосфонуклеотидів - АТФ, ГТФ, ТТФ і ЦТФ);
2) транскрипції (мутаційні дефекти генної матриці, інгібування ДНК-залежної РНК-полімерази антибіотиками й токсинами, порушення посттранскрипційної модифікації інформаційної РНК: неприєднання "кепа" до головного кінця молекули, порушення утворення полі-А-хвоста, розлади сплайсингу тощо);
3) трансляції (дефіцит або якісні зміни інформаційної, рибосомної або транспортної РНК, а також рибосомних ферментів і нєферментних білків; дефіцит вільних амінокислот і АТФ; інгібування процесу антибіотиками й мікробними токсинами).
11.19. Які існують універсальні механізми підвищення проникності клітинних мембран при ушкодженні клітини?
Підвищення проникності клітинних мембран може бути обумовлене:
1) активацією пероксидного окиснення ліпідів;
2) активацією фосфоліпаз;
3) осмотичним розтягненням мембран;
4) адсорбцією білків (поліелектролітів) на мембрані;
5) змінами фазового стану мембранних ліпідів (ацидоз, зміна температури).
/1.20. Які порушення виникають у клітині в результаті ушкодження окремих її органоїдів (плазматичної мембрани, мітохондрій, ендоплазматичногоретикулуму лізосом)?
Порушення бар'єрної функції плазматичної мембрани призводить до вирівнювання існуючих у нормі концентраційних градієнтів речовин: у клітину надходять іони Na+, Са2+, СІ", а виходять іони К+, Mg2+, неорганічного фосфату, низько- і високо-молекулярні органічні сполуки (АМФ, АДФ, проміжні продукти клітинного обміну, білки-ферменти). З ушкодженнями білків і глікопротеїдних комплексів, вбудованих у плазматичну мембрану, пов'язані порушення систем активного транспорту речовин (Na-K-, Са-насосів; Na-Ca- і Na-H-обмінних механізмів); зміни специфічних іонних каналів (Na-, K-, Са-каналів); порушення клітинних рецепторів, що сприймають зовнішні регуляторні сигнали (а- і )3-адренорецепторів, ш- і n-холінорецепторів та ін.); порушення міжклітинних взаємодій; зміни антигенних властивостей клітини.
Ушкодження мітохондрій супроводжується або пригніченням процесів клітинного дихання, або ефектом роз'єднання процесів окиснення й фосфорування. І в тому, і в другому випадку результатом розладів мітохондріальних функцій буде порушення енергозабезпечення клітини (рис. 36).
Ушкодження шорсткого ендоплазматичного ретикулуму призводить до деза-грегації полісом, унаслідок чого порушуються реакції біосинтезу білка в клітині. У результаті ушкодження гладкого ендоплазматичного ретикулуму і його ферментних систем страждають процеси детоксикації, мікросомного окиснення та ін. У деяких
клітинах, наприклад м'язових, порушується здатність ендоплазматичного (саркоплазма-тичного) ретикулуму депонувати іони Са2+, що сприяє реалізації так званих кальцієвих механізмів ушкодження клітини.
Підвищення проникності лізосомних мембран призводить до виходу в цитоплазму гідролітичних ферментів, активація яких у кінцевому підсумку викликає необоротні зміни клітини — її аутоліз.
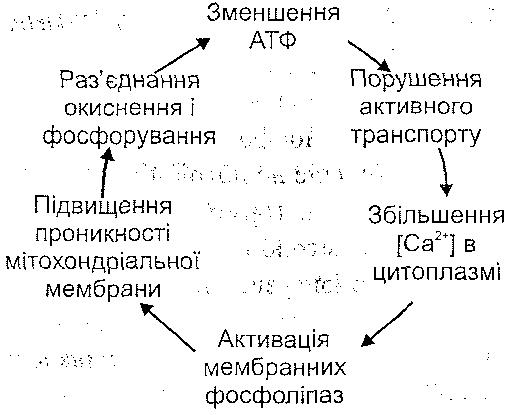
Рис. 36. Роль дефіциту АТФ в ушкодженні клітини
11.21. Які існують механізми загибелі клітин? Чим вони принципово відрізняються?
Розрізняють два механізми загибелі клітин: некроз і апоптоз.
Некроз - це загибель необоротно ушкоджених клітин, яка відбувається за участю лізосомних ферментів, що здійснюють гідролітичне розщеплення усіх компонентів клітини (аутоліз), руйнують плазматичну мембрану і зумовлюють вихід вмісту клітини за ЇЇ межі в навкружну тканину з наступним розвитком запалення.
Апоптоз— це шлях запрограмованої загибелі клітин ("самогубство"), що відбувається за участю спеціально призначених для цього активованих ферментів (кас-паз), які руйнують власну ДНК, ядерні білки і білки цитоскелета, не ушкоджуючи при цьому плазматичну мембрану.
Основні відмінності між некрозом і апоптозом представлено в табл.
Властивості |
Некроз |
Апоптоз |
Об'єм клітини |
Збільшений (набряк) |
Зменшений (стиснення) |
Ядро |
Пікноз → каріорексис —f каріолізис |
Фрагментація - розпад на окремі фрагменти (нуклеосоми) |
Плазматична мембрана |
Розірвана |
Інтактна |
Вміст цитоплазми |
Ферментативне перетравлювання лізосомними ферментами (аутоліз), вихід вмісту клітини за її межі |
Інтактний |
Викликає запалення в тканині |
Часто |
Ніколи |
Фізіологічне чи патологічне явище |
Завжди патологічне (кульмінація незворотного ушкодження клітин) |
Часто фізіологічне (генетично запрограмована загибель клітин); може бути патологічним після деяких видів ушкодження клітин, особливо після ушкодження ДНК |
11.22. Назвіть основні причини апоптозу.
