
- •Принципы классификации ферментов.
- •Понятие «moonlighting» ферментов.
- •Скорость химической реакции. Порядок реакции. Основные характеристики ферментативной реакции.
- •Понятие метаболон. Примеры метаболонов.
- •Требования к ферменту, образующему ядро метаболона и связывающемуся с подложкой:
- •Принципы взаимного расположения ферментов в метаболоне:
- •Теория переходного состояния.
- •Нуклеофильные и электрофильные группы ферментов. Участие в катализе.
- •Принципы классификации лиаз. Примеры лиазных реакций. Механизм альдолазной реакции.
- •Обзор методов наблюдения за ферментативной реакцией. Требования к проведению кинетических экспериментов.
- •Методы:
- •Характерные особенности метаболонов.
- •Основные этапы и направления развития энзимологии.
- •Билет 11.
- •Количественный анализ кооперативности.
- •Модель Моно-Шанже-Уайман
- •Колориметрические методы контроля ферментативной реакции. Примеры.
- •Принципы классификации ферментов.
- •Модели «изменяющейся центровой реактивности» олигомерных ферментов.
Нуклеофильные и электрофильные группы ферментов. Участие в катализе.
Ковалентный катализ основан на атаке нуклеофильных (отрицательно заряженных) или электрофильных (положительно заряженных) групп активного центра фермента молекулами субстрата с формированием ковалентной связи между субстратом и коферментом или функциональной группой аминокислотного остатка (как правило, одной) активного центра фермента.
Нуклеофилы Отрицательно заряженный кислород (непротонируемая гидроксильная группа или ионизованная карбоксильная), Отрицательно заряженный сульфгидрил, Карбанион, Незаряженная аминогруппа, Имидазол, Гидроксид ион
Электрофилы: Протон, Углеродный атом карбонильной группы (более электроотрицательный кислород оттягивает электроны от углерода), Протонированная иминогруппа (активированние для нуклеофильной атаки на углерод путем протонирования имина), Фосфор или фосфатная группа.
К
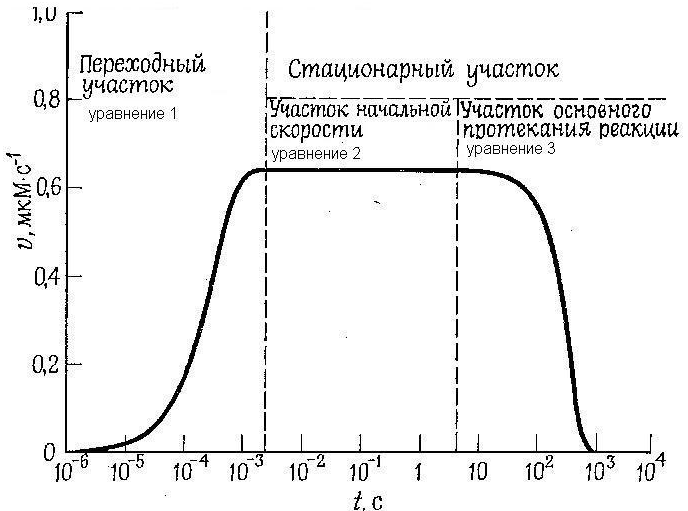 инетическая
кривая ферментативных реакций. Изменение
скорости реакции во времени (в зависимости
от степени конверсии).
инетическая
кривая ферментативных реакций. Изменение
скорости реакции во времени (в зависимости
от степени конверсии).
Р

 Vср <
V0
P(t)
Vср <
V0
P(t)
dP/dt
t
Олигомерные ферменты. Кинетика, регуляция.
Билет 8.
Особенности ферментативного катализа.
Высокая эффективность – ускоряют реакции минимум в миллион раз. Не сдвигают равновесия реакций. Эффективность определяется ускорением реакции в сравнении с конгруэнтной реакцией (реакция аналогичная ферментативной, проходящая через те же промежуточные состояния, но без участия фермента)
Специфичность по отношению к субстратам и продуктам реакции (отсутствие побочных продуктов). Специфичность фермента означает, что скорость катализируемой реакции меняется в 103-104 раза при небольшой хим. модификации субстрата. Вопрос о зависимости скорости ферментативной реакции от концентраций субстратов, ингибиторов и активаторов решают с помощью математического моделирования.
Различают несколько типов специфичности: абсолютная специфичность— фермент катализирует превращение строго определенного вещества ; стереоспецифичность— фермент катализирует превращение только одного стереоизомера ; групповая специфичность — фермент катализиpyет превращения группы субстратов, имеющих одинаковую химическую группу, или имеющих общий тип связи. Некоторые ферменты каталитически неактивны в отсутствии ионов металлов или коферментов.
Активны при физиологических условиях (рН, t, давление и т.д.)
Регулируемость ферментативных реакций особенно так называемых ключевых, скорость-лимитирующих реакций.
Уровни регуляции: на уровне транскрипции и трансляции - увеличение количества транслируемой мРНК фермента. Негеномная регуляция – (изменение конформации) ковалентные модификаций (включая гормональную регуляцию), алостерическая регуляция, в метаболических путях часто представлена регуляция скорости начальных (обычно скорость-лимитирующих) реакций пути конечными продуктами (иногда этот тип регуляции называют ретроингибированием). Активность фермента также регулируется временем полужизни фермента. Более подробно типы регуляции будут рассмотрены далее на примере ключевого фермента биосинтеза холестерина – гидроксиметилглутарил СоА редуктазы.
Метод оценки параметров уравнения М-М по прогрессивной кривой ферментативной реакции (метод Уокера-Шмидта).
Картирование аминокислотных остатков активного центра. Свойства «каталитических» аминокислотных остатков.
Сайт-специфический мутагенез, изменение химического строения определенных а.к.о.. и далее оценка кинетических характеристик. Чаще всего в каталитических центрах однокомпонентных ферментов встречаются остатки Сер, Гис, Три ,Арг, Цис, Асп, Глу и Тир. Радикалы перечисленных аминокислот выполняют здесь ту же функцию, что и кофермент в составе двухкомпонентного фермента.
Аминокислотные остатки, образующие каталитический центр однокомпонентного фермента, расположены в различных точках единой полипептидной цепи. Поэтому каталитический центр возникает в тот момент, когда белковая молекула приобретает присущую ей третичную структуру. Следовательно, изменение третичной структуры фермента под влиянием тех или иных факторов может привести к деформации каталитического центра и изменению ферментативной активности.
Билет 9.
