
- •Принципы классификации ферментов.
- •Понятие «moonlighting» ферментов.
- •Скорость химической реакции. Порядок реакции. Основные характеристики ферментативной реакции.
- •Понятие метаболон. Примеры метаболонов.
- •Требования к ферменту, образующему ядро метаболона и связывающемуся с подложкой:
- •Принципы взаимного расположения ферментов в метаболоне:
- •Теория переходного состояния.
- •Нуклеофильные и электрофильные группы ферментов. Участие в катализе.
- •Принципы классификации лиаз. Примеры лиазных реакций. Механизм альдолазной реакции.
- •Обзор методов наблюдения за ферментативной реакцией. Требования к проведению кинетических экспериментов.
- •Методы:
- •Характерные особенности метаболонов.
- •Основные этапы и направления развития энзимологии.
- •Билет 11.
- •Количественный анализ кооперативности.
- •Модель Моно-Шанже-Уайман
- •Колориметрические методы контроля ферментативной реакции. Примеры.
- •Принципы классификации ферментов.
- •Модели «изменяющейся центровой реактивности» олигомерных ферментов.
Билет 1.
Принципы классификации ферментов.
По ферментативной реакции:
По субстрату (+ окончание аза)
По типу катализируемой реакции (международная система классификации)
По «белковым» классификациям:
Простые и сложные (Содержат помимо белковой части (апофермента) кофермент или простетическую группу)
По укладке (фолдингу) (Классификация в системах SCOP, CAHT и др.)
Каждый индивидуальный фермент может быть назван по-разному. Тривиальное название (трипсин, папаин) присваивали произвольно, по нему трудно судить о природе реакции, катализируемой ферментом. В рациональной номенклатуре название каждого фермента составляется из названия субстрата реакции и характерного окончания –аза (например, креатинкиназа, уреаза, амилаза, триозофосфатизомераза, и т.д.). Она была предложена более столетия тому назад, в 1898 г. Э. Дюкло и до сих пор широко используется в биохимии. Номенклатура ферментов, являющихся сложными белками (содержащими кофактор или простетическую группу), использует название ферментов по простетической группе (или кофактору), например, геминовые ферменты (простетическая группа - гем), пиридоксалевые ферменты (простетическая группа – пиридоксаль), флавиновые ферменты (содержащие рибофлавин), никотинамидные ферменты (кофактор пиридиннуклеотид) и т.п.
Расшифровка третичной структуры и создание белковых баз данных и систем классификаций белковых молекул по фолдингу делает возможным охарактеризовать фермент предварительно по элементам трехмерной структуры, даже если в данный момент трехмерная структура данного представителя не расшифрована. Поиск консенсусных последовательностей и мотивов в первичной структуре при выравнивании первичных последовательностей часто дает возможность предварительно определить местоположение фермента в системе белковой классификации. Сопоставление сведений о трехмерных структурах и каталитичеки важных аминокислотных остатках у представителей суперсемейства может давать предварительную информацию (которая часто подтверждается) о каталитических аминокислотных остатках или механизме катализа.
В международной системе классификации и номенклатуры используют четырехзначный код для каждого индивидуального фермента – КФ (1-6).Х.Х.Х.
Схема номенклатуры ферментов была впервые разработана в 1955 году, когда Международный конгресс биохимии учредил Комиссию по ферментам (Enzyme Commission). Первая версия номенклатуры, появившаяся в 1961 году включала около 900 ферментов, современная версия содержит около 4000 ферментов.
Принцип классификации основан на типе катализируемой ферментом реакции, выделено 6 основных классов, имеющих соответствующие цифровые обозначения. Порядковый номер закреплен за каждым классом фермента и образует первую цифру в четырехзначном индивидуальном шифре для каждого фермента в международной системе номенклатуры ферментов. Каждый фермент по классификации ферментов (КФ, ЕС) обозначается четырьмя цифрами (шифр фермента): 1 — класс, 2 — подкласс. 3 — подподкласс, 4 — номер фермента.
1.Оксидоредуктазы — это ферменты, катализирующие окислительно-восстановительные реакции с участием двух субстратов А и В.
2.Трансферазы — это ферменты, катализирующие реакции межмолекулярного переноса группы Х (отличной от атома водорода) с одного субстрата на другой.
3.Гидролазы это ферменты, которые катализируют расщепление внутримолекулярных связей с участием воды.
4.Лиазы — это ферменты, отщепляющие группы от субстратов по негидролитическому механизму с образованием двойных связей и присоединением веществ по месту двойной связи.
5.Изомеразы катализируют превращения различных типов оптических, геометрических и позиционных изомеров.
6.Лигазы (синтетазы) катализируют соединение двух молекул, сопряженное с разрывом пирофосфатной связи АТФ или другого макроэргического соединения.
Линеаризация уравнения М-М.
Тут нужно обратиться к конспекту, ибо кучу формул я просто не осилю вбивать сюда.
Наблюдение за ходом креатинкиназной реакции с помощью сопряженной системы Росалки.
В случае реакции креатинкиназы нет возможности простыми спектрофо-тометрическими методами наблюдать расход субстратов (креатинфосфата и ADP) или накопление продуктов (креатина или АТР). В то же время известно, что NAD(P)-зависимые ферменты легко контролируются спектрофотометрическими методами благодаря изменению поглощения света при превращении NAD(P) в NAD(P)Н. На этой идее базируется метод, предложенный Росалки и применяемый в системе определения активности креатинкиназы. Метод основан на использовании сопряженной системы ферментов гексокиназа - глюкозо-6-фосфатдегидрогеназа. За ходом реакции следят по изменению оптической плотности, обусловленному накоплением восстановленной формы пиридинового нуклеотида, количество которого эквивалентно количеству АТР, образовавшемуся в ходе «обратной» креатинкиназной реакции:
КК
ADP + Креатинфосфат —→ Креатин + ATP,
ГК
ATP + Глюкоза —→ ADP + Глюкозо-6-фосфат,
гл-6-Р-ДГ
Глюкозо-6-фосфат + NAD(P) ———→ 6-Р-глюконат + NAD(P)H.
Естественно предположить, что добавление новых стадий должно усложнить математическое описание процесса в целом, что и доказано теоретическими исследованиями разных авторов. Кинетическая кривая сопряженной системы обязательно состоит из предстационарного периода, на котором скорость реакции нарастает, достигая стационарного значения, и квазистационарного участка, где скорость убывает согласно законам ферментативной кинетики (рис. 23, Б2). Предстационарный период наблюдается потому, что системе требуется некоторое время для накопления достаточного количества промежуточных продуктов. Приближенное решение системы уравнений приводит к оценке лаг-периода процесса: τ = K1/V1 + K2/V2, где Ki и Vi — кинетические параметры второго и третьего фермента сопряженной системы (гексокиназы и глюкозо-6-фосфат-дегидрогеназы). Скорость суммарной реакции на квазистационарном участке достаточно близка к начальной скорости первого, то есть исследуемого фермента. Точный анализ той же сопряженной системы дает оценку τ = Σ Ki/(Vi – v0), где v0 — начальная скорость на первой стадии совокупного процесса. То есть время достижения стационарного участка зависит не только от характеристик второго и третьего фермента в цепи реакций, но и от концентраций субстратов первого фермента, так как они влияют на величину v0. Отсюда можно сделать вывод, что для более точного определения скорости реакции на квазистационарном участке кинетической кривой необходимо проводить запись процесса в течение некоторого времени, достаточного для захвата этого характерного участка. Для описания процесса можно выбирать максимальное значение скорости на указанном временном промежутке. Оценивание скорости в некоторый заранее установленный момент времени, как это рекомендуется в оригинальном методе Росалки при определении активности креатинкиназы, должно приводить к введению некоторой систематической ошибки в кинетические данные, используемые для анализа модели.
Билет 2.
Предмет изучения ферментативной кинетики. Примыкающие к этой дисциплине разделы науки.
Ферментативная кинетика занимается созданием моделей, изучением сложных ферм реакций, изучает структуры и физ-хим механизмы действия ферментов.
Разделы:
- химическая кинетика. Описание протекания хим реакций во времени. Система уравнений (диф), описывающих изменения концентраций реагентов во времени:
А----------P
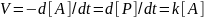 A+В
-
P+Q
A+В
-
P+Q
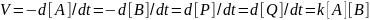
- энзимология
Механизмы ферментативного катализа.
Эффект сближения
Фермент ускоряет реакцию между субстратами путем удерживания их в сближенном состоянии и нужной ориентации.
Кислотно-основной катализ
Увеличение реакционной способности группы путем увеличения электрофильности или нуклеофильности. Обобщенная кислота – донор электронов (е). Обобщенное основание – акцептор е. одни и те же группы могут быть в роли OK (-COOH, -N+H3, -SH) и OO (-COO-, -NH2, -S-). Всё зависит от степени ионизации.
Ковалентный катализ
Образование нестабильных ковалентных фермент-субстратных комплексов в ходе катализа. Например, амк может присоединить какие-то группировки: фермернт, содержащий –SH-группу, образует мостик с –SH-группой аминокислоты. Модель ковалентного катализа:
Некатализируемая реакция: RX + H2O -> ROH + HX
Катализируемая реакция: RX = E-OH -> ROH + EX, EX + H2O -> E-OH + HX. Суммарная рекция как первая.
Структурная подвижность ферментов
Индуцированное взаимосоответствие молекул субстрата и фермента приводит к напряжению и деформации разрываемой связи.
