
Технологическая схема производства
Для розлива минеральной воды применяют минеральную воду из скважины 1-Э. Минеральная вода перед розливом подвергается следующей обработке:
накапливание в приемные резервуары;
фильтрованию;
обеззарараживанию;
охлаждению;
насыщением двуокисью углерода;
приготовление ПЭТ-бутылок;
розлив и подача готовой продукции на склад
Накапливание
Минеральная вода из скважины 1Э из глубины 440 м поднимают с помощю глубинного насоса. По трубопроводам подаются в накопительные резервуары.
Фильтрование минеральных вод.
Взвешенные вещества, содержащиеся в воде, вызывают помутнение воды и снижают эффективность бактерицидной обработки ее. Поэтому все воды перед розливом освобождают от взвешенных частиц. Для удаления из вод взвешенных частиц применяют метод фильтрования. Фильтрация воды происходит на фильтровальном блоке, наполненный песком и фильтрационными материалами.
Обеззараживание минеральных вод.
Основная цель обеззараживания вод состоит в уничтожении микроорганизмов. Для обеззараживания воды подвергается обработке ультрафиолетовыми лучами в установке УФ
Охлаждение минеральных вод.
Растворимость газов повышается с понижением температуры. Поэтому на газирование вода поступает охлажденной. Глубокому охлаждению воды не подвергаются, так как это может привести к уменьшению растворимости солей, содержащих в воде и выпадению их в осадок. Охлаждение воды происходит на пластинчатом теплообменнике .
Насыщение минеральных вод двуокисью углерода.
Насыщение минеральных вод двуокисью углерода происходит на импортном оборудовании Содамих марки. Растворимость двуокиси углерода в воде зависит от температуры воды и давления, при котором ведется насыщение ее двуокисью углерода.
Приготовление ПЭТ бутылок
Преформы подаются в загрузочный бункер и подаются в СБО. В СБО преформы нагреваются и под высоким давлением воздуха придается форма бутылок. Затем приготовленные бутылки подаются на воздушный конвейер при помощи, которой бутылки подаются на моноблок. Розлив и укупорка происходит на моноблоке.
Основное обарудывание производства минеральной воды
Комплект оборудования в линию розлива минеральной воды в ПЭТ-бутылку производительностью 3000-6000 бут/ч
Технические данные проекта:
Продукт: минеральная вода
Тара: ПЭТ бутылка различной геометрии по желанию заказчика
Вместимость: от 250 до 2000 см3
Укупорка: крышка пластмассовая винтовая
Этикетка: по предложению заказчика
Производительность: до 6000 бут/ч
Уст. мощность: не более 130 кВт
Расход воды: не более 5 м3/ч
Расход воздуха: не более 25 м3/ч (без выдува)
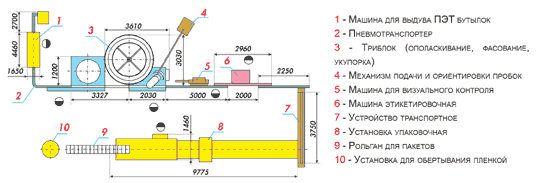
Транспортер б3-втв-6
Устройство транспортное преднозначено для перемещения вертикально ориентированных пластмассовых бутылок вместимостью от 250 до 2000 см3 потоком воздуха от ориентатора к конвееру линии для упаковывания жидкой пищевой продукции.
Машина ополаскивающая б3-омв-6
Машина предназначена для ополаскивания стеклянных и ПЭТ бутылок путем обмыва внутренней поверхности водопроводной водой с целью удаления пыли и легкосмываемых загрязнений, не имеющих прочной механической связи с поверхностью бутылок. Машина роторного типа. Бутылка в захватывающем устройстве движется вдоль копира.

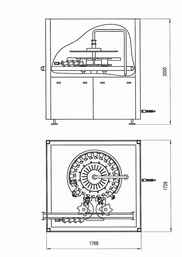
Принцип работы:
С входных шнеков бутылка поступает на звездочку загрузки, а затем на карусель ополаскивания, где захватывается за горло захватами с резиновыми подушками.
Захваты скользят по неподвижной направляющей, обеспечивающей радиальное опрокидывание бутылок. Бутылки точно фиксируются на форсунках которые впрыскивают ополаскивающую жидкость на заданное время. Когда впрыск закончен, начинается цикл стекания. После стекания воды бутылка переворачивается и промежуточными звездочками подается на карусель налива.
Ополаскивающая жидкость собирается в поддоне, для предотвращения протекания на стол машины. Время ополаскивания может устанавливаться производителем.
Во время процесса ополаскивания внешняя поверхность бутылок остается сухой, что обеспечивает качественное наклеивание этикеток.
За счет оптимального размера карусели ополаскивания уменьшается проблема "остаточной капли"
Сатураторные установки
Предназначены для приготовления газированной воды и отпуска ее покупателям с сиропом или без сиропа.
Газированная вода получается путем насыщения водопроводной воды углекислым газом. При растворе углекислого газа в воде происходит химическая реакция с образованием угольной кислоты (Н2С03), от чего вода приобретает кислый вкус. Газированная вода хорошо утоляет жажду, способствует лучшему усвоению пищи. Интенсивность растворения газа в воде зависит от температуры и давления. Чем ниже температура и выше давление, тем лучше растворяется газ. Вот почему перед поступления в сатуратор вода охлаждается, и в нем поддерживается постоянное давление. Готова газировка должна содержать углекислого газа не менее 0,7% массы, что составляет 4г С02 на 1 л воды.
Сатураторные установки непрерывного действия состоит из авто-сатуратор АС-1, углекислотного баллона, редуктора УР-2, водоохладители и стаканомийкы.
Механизм автосатуратора АС-1 смонтирован на металлической основе, с помощью которой он крепится к стойке.
Механизм закрывается кожухом и пломбируется.На передней стороне кожуха находятся рукоятки для отпуска газированной воды, для сиропа и сливной кран. На задней стороне кожуха прикреплены две колбы с сиропом. Автосатуратор подключается к водопроводу, к баллону с углекислым газом, до колб с сиропом. И Иродуктивнисть - 6-8 видпускань за минуту при величине дозы газированной воды 180 ± 10 мл, сироп 20 ± 1 мл.
Использование автосатуратора позволяет автоматизировать процесс приготовления газированной воды при постоянном давлении газа 0,4 МПа (4кгс/см3) и воды 0,2 МПа (2кгс/см3). Это обеспечивает высокое качество воды, автосатуратор занимает мало места, имеет большую производительность и менее опасен в эксплуатации.
Состав воды. Количество параметров качества воды
Обычно под хим. составом минвод подразумевают солевой состав (качественный и количественный). Но соли, образующиеся при связывании ионов друг с другом, могут присутствовать в растворе в значительных количествах только при высокой минерализации вод, когда степень диссоциации (ионизации, разъединения на ионы) очень слаба. Поэтому говорить о солевом составе минеральных вод можно лишь предположительно.
Наглядное представление о химическом составе воды даёт формула М. Г. Курлова (формула, предложенная М. Г. Курловым и Э. Э. Карстенсом), и выглядит она следующим образом:
![]() м3/сут.
м3/сут.
Индекс у буквы «M» в формуле показывает общую минерализацию — содержание солей в граммах на литр, дробь — ионный состав. В числителе стоят анионы (отрицательно заряженные ионы), в знаменателе — катионы (положительно заряжённые ионы). Даны они в сопоставимых единицах — процент-эквивалентах — и показаны в убывающем порядке. Сумма тех и других порознь — 100. pH — водородный показатель активной реакции (щелочности-кислотности) воды, T — температура воды в градусах по Цельсию, D — суточный дебит воды, измеряемый в кубических метрах.
При определении предполагаемого солевого состава по этой формуле необходимо знать и учитывать, что очередность связывания ионов друг с другом происходит в строго определённом порядке. Существует своего рода «сословная градация»: правом приоритета среди анионов пользуется хлор. С него и начинается определение состава солей, независимо от того, на каком месте он стоит в формуле М. Г. Курлова. Вторыми идут сульфаты, на третьем месте — гидрокарбонаты. Среди катионов наиболее активен натрий, следующим стоит магний, и последним — кальций (в формуле он стоит последним всего лишь потому, что их количества [процентные] с магнием одинаковые, — то есть он расположен по химической иерархии).
Хлор, первым вступая в реакцию, создаёт группу хлоридов. Сначала он с ионами натрия образует хлористый натрий (поваренную [или «каменную»] соль NaCl), если ионов натрия не хватит, свободные ионы хлора начнут соединяться с магнием, образуя хлористый магний (MgCl2 — основа бишофита[15]). А оставшиеся соединятся с кальцием, создавая хлористый кальций (CaCl2). Если же мало хлора, то есть его не хватит на кальций и даже на магний, этих разновидностей не будет в растворе.
Затем в реакцию вступают сульфат-ионы. Порядок соединения с катионами такой же. Если хлор не связал весь натрий, сульфат-ионы создают серно-кислый натрий (глауберову соль Na2SO4). Кроме того, они могут образовать сернокислый магний (магнезию, или английскую ["горькую"] соль MgSO4) и серно-кислый кальций (гипс CaSO4). Так будет в том случае, если после соединения с хлором в растворе ещё имеются все три катиона и достаточно сульфат-ионов. В случае, когда какие-либо из катионов полностью использованы хлором, в растворе не будет соответствующей сернокислой соли.
В последнюю очередь в реакцию включаются гидрокарбонат-ионы. Они используют оставшиеся катионы в том же порядке. Бывает, что хлора и сульфат-ионов в воде очень мало или же ионов натрия настолько много, что после соединения с двумя первыми анионами часть их остаётся несвязанными. В этих случаях гидрокарбонат-ионы образуют двууглекислый натрий (питьевую соду NaHCO3), а при наличии двух других катионов — гидрокарбонаты магния [Mg(HCO3)2] и кальция [Ca(HCO3)2] (доломитные нарзаны).
Приведённая для примера формула показывает, что в одном литре данной воды содержится в процентах от общей минерализации 5,3 грамма солей: хлористого натрия — 30, сульфата натрия (глауберовой соли) — 20, и гидрокарбонатов магния и кальция — по 25 процентов.
В нашем примере, как явствует из формулы, половину анионов составляют гидрокарбонаты и половину катионов — натрий. Однако это вовсе не свидетельствует о присутствии гидрокарбоната натрия (щелочей), как может показаться на первый взгляд. Хлор по праву наиболее сильного выйдет на арену первым и соединится с натрием, образовав поваренную соль, — 30 % от общей минерализации, а остатки этого катиона заберут сульфат-ионы, создав глауберову соль (20 %). На долю гидрокарбонатов останутся магний и кальций (согласно, опять же, иерархии «доступа»), которые характеризуют жёсткость воды. Щелочей в этой воде [практически] нет.
