
- •1. Шихтовые материалы электроплавки
- •1.Источники образования лома
- •2. Классификация лома
- •3. Альтернативная металлошихта для электроплавки
- •4. Подготовка металлошихты к переплаву
- •2. Сортамент электростали
- •3. Технологии выплавки стали в дсп.
- •1. Плавка на свежей шихте
- •2. Переплав легированных отходов
- •3. Плавка на металлизованных окатышах
- •4. Выплавка стали в кислых печах
- •5. Особенности плавки в большегрузных печах
- •6. Расчет металлошихты
- •4. Дуговая сталеплавильная печь
- •1.Конструкция дсп
- •1) Корпус
- •Корпус дсп
- •Свод дсп
- •3) Опорная платформа
- •4) Механизм наклона
- •5) Электрододержатель и механизм передвижения электрода
- •6) Механизмы подъема и поворота свода
- •7) Система удаления и очистки технологических газов
- •2. Футеровка дсп
- •Футеровка подины
- •Футеровки свода
- •3. Требования к электродам
- •4. Использование кислорода в дсп
- •5. Особенности плавки в сверхмощных дуговых печах
- •5. Внепечная обработка стали
- •1.Особенности процессов внепечной обработки.
- •2.Продувка стали в ковше инертным газом.
- •3. Внепечное вакуумирование стали
- •1) Вакуумирование в ковше
- •2) Вакуумирование в струе.
- •3) Порционное вакуумирование.
- •4) Циркуляционное вакуумирование.
- •6. Вредные примеси в стали
- •1. Окислительные реакции в стали
- •1) Содержание кислорода в металле в окислительный период плавки.
- •2) Фосфор в металле
- •3) Обезуглероживание
- •2. Газы в стали
- •Водород в стали.
- •Водород в стали в процессе плавки.
- •Азот в стали. Растворимость азота в железе и влияние его на свойства стали.
- •Азот в стали в процессе плавки.
- •3. Раскисление стали.
- •7. Спецэлектрометаллургия
- •1. Вакуумные дуговые печи
- •2. Установки электрошлакового переплава
- •4. Установки плазменно-дугового переплава в водоохлаждаемый кристаллизатор
1) Содержание кислорода в металле в окислительный период плавки.
Реакция взаимодействия углерода и кислорода, растворенного в жидком железе, имеет вид:
[C]+[O]=CO(г);Go=-22400-39,7T Дж
![]() ,тогда
можно записать следующее уравнение:
,тогда
можно записать следующее уравнение:
m = [C][O] / PCO = 1 / KC fC fO.
При постоянном давлении m = [C][O].
Величина m была впервые определена Вачером и Гамильтоном. Так, при t = 1580-1620C и PCO = 1 атм при низком содержании углерода в металле m = 0,0025 и остается постоянным.
Зависимость равновесной концентрации кислорода в металле от концентрации углерода (m = 0,0025) на рис. представлена кривой 1, а экспериментальные данные в окислительной период плавки в ДСП - кривой 2.
Проведенная по экспериментальным точкам кривая 2 описывается, по данным Д.Я.Поволоцкого, уравнением:
![]()
Из представленных данных видно, что в окислительный период плавки зависимость содержания кислорода в металле от содержания углерода имеет такой же харак-
2
1
К концу продувки содержание углерода в расплаве должно быть примерно на 0,1 % ниже нижнего предела для выплавляемой марки стали, но не ниже 0,1 %, чтобы предотвратить переокисление металла, за исключением тех случаев, когда выплавляют стали, в которых углерод является нежелательной примесью (например в некоторых марках нержавеющей стали).
В конце окислительного периода содержание фосфора в стали не превышает 0,01 %, а шлак имеет состав, %:
СаО - 40-50; SiO2 - 10-20; FеО - 15-20; МnО - 5-12; Мg0 - 6-10; А12О3 - 2-3;
Р2О5- до 1,5, а его количество составляет 2-4 % от массы металла.
2) Фосфор в металле
Рафинирование металла при плавке стали в дуговой печи осуществляется в окислительных и восстановительных условиях. В качестве основной примеси, удаляемой в окислительных условиях (период расплавления, окислительный период) считается фосфор, требующий особого внимания при сталеварении.
Фосфор является вредной примесью в подавляющем большинстве марок стали. В твердой стали образуются фосфиды железа, которые находятся в растворе в виде более прочных соединений, чем карбиды железа. Фосфор вытесняет углерод из карбидов. При высоком содержании фосфора сталь приобретает свойство хладноломкости, т.е. склонность давать трещины при деформации в условиях обычной температуры.
Максимальное содержание фосфора в металле ограничивается с учетом возможности проведения процесса дефосфорации и требований, предъявляемых к металлу. Предельная концентрация фосфора для большинства марок стали, например, хладостойких, работающих в районах крайнего Севера снижена до 0,008-0,015%. По требованию потребителя и для ряда марок коррозионностойкого металла доля фосфора не должна превышать 0,015%.
В
настоящее время дефосфорация стали
осуществляется в так называемых
окислительных условиях, характеризующихся
окисленностью системы, отвечающей
![]() (равновесному
парциальному давлению кислорода) более
10-10-10-8
атм. Это позволяет решить задачи по
дефосфорации расплавов, не содержащих
легкоокисляющиеся элементы, такие как:
хром, марганец, ванадий и др. Дефосфорация
высоколегированных сталей остается
проблемой несмотря на то, что предлагаются
различные подходы к ее решению, например:
дефосфорация в слабоокислительных или
восстановительных условиях, либо за
счет перевода фосфора в газовую фазу.
Однако способы дефосфорации расплавов,
содержащих элементы с высоким сродством
к кислороду, еще требуют серьезных
дополнительных исследований.
(равновесному
парциальному давлению кислорода) более
10-10-10-8
атм. Это позволяет решить задачи по
дефосфорации расплавов, не содержащих
легкоокисляющиеся элементы, такие как:
хром, марганец, ванадий и др. Дефосфорация
высоколегированных сталей остается
проблемой несмотря на то, что предлагаются
различные подходы к ее решению, например:
дефосфорация в слабоокислительных или
восстановительных условиях, либо за
счет перевода фосфора в газовую фазу.
Однако способы дефосфорации расплавов,
содержащих элементы с высоким сродством
к кислороду, еще требуют серьезных
дополнительных исследований.
Термодинамические условия дефосфорации металла в окислительных условиях. В данном случае удаление фосфора проводят путем его окисления и перевода в шлак. Для понижения активности продуктов реакции в шлак добавляют известь. Согласно представлениям молекулярной теории шлака, процесс дефосфорации можно описать уравнением (2.1)
2[Р] + 5(FeO) + 4(СаО) = (4СаО) • (Р2О5) + 5Fe (2.1)
Экспериментальные данные о равновесии реакции, полученные Уинклером и Чилманом /1/, имеют следующий вид:
![]() (2.2)
(2.2)
Величина (СaО)' представляет мольную долю СаО, не связанную в соединения с кислотными оксидами, и может быть определена как:
![]() (2.3)
(2.3)
Проведем анализ влияния температуры на константу равновесия реакции. С увеличением температуры константа уменьшается, следовательно, процесс дефосфорации протекает хуже (значение энтальпии реакции (H) равно -76600 Дж/моль, т.е. реакция идет с выделением тепла). Коэффициент распределения фосфора может быть представлен выражением (2.4)
![]() (2.4)
(2.4)
Таким образом, увеличение окисленности системы, повышение основности шлака и активности фосфора способствуют дефосфорации металла. На риc. 2.4 показано влияние основности (В), активности шлака (FeO) и температуры на коэффициент распределения фосфора (LP).
Как показывает практика, весьма важно поддерживать и определенное соотношение между оксидами кальция и железа в шлаке. Рекомендуемое отношение
(СаО)/(FeO) около 2,5-3,5. Требования по избытку основных оксидов в шлаке делает
дефосфорацию металла возможной лишь при обработке расплава в основных агрегатах при активном взаимодействии двух фаз – металл и шлак, причем это может быть осуществлено как в плавильном агрегате, так и в ковше. в том числе специальными шлаковыми смесями, отвечающими вышеперечисленным требованиям. Весьма важна правильная количественная оценка технологических параметров. Температура процесса, содержание оксида кальция в шлаке, основность и окисленность шлака, кратность шлака.
Практически можно с той или иной степенью точности ответить на любой вопрос, связанный с дефосфорацией стали, решив систему уравнений, включающую балансовое уравнение по фосфору и коэффициент распределения фосфора. Балансовое уравнение, с учетом известного исходного состава фосфора в металле [Р]ucx и шлака (Р2О5)ucx, может быть записано в виде:
![]() , (2.5)
, (2.5)
где Q - количество металла и шлака, соответственно перед и после обработки расплава;
а - коэффициент, учитывающий количество фосфора (Р) в оксиде (Р2О5).
Коэффициент распределения фосфора Lp можно принять либо по литературным данным, исходя из принимаемых условий дефосфорации, либо воспользоваться ниже приведенными и часто используемыми эмпирическими и термодинамическими зависимостями:
![]() (2.6)
(2.6)
![]() (2.7)
(2.7)
где ![]() –
параметр, характеризующий фосфатную
емкость шлака, ее значение для
окислительного шлака плавки в дуговой
печи может быть принято равным 1018,5.
–
параметр, характеризующий фосфатную
емкость шлака, ее значение для
окислительного шлака плавки в дуговой
печи может быть принято равным 1018,5.
Фосфатная емкость шлака принята в качестве параметра, характеризующего емкость флюса по отношению к фосфору в окислительных условиях /2, 3/. Ее значение можно определить, записав переход фосфора в оксидный шлак согласно ионной теории шлака (2.8):
![]() (2.8)
(2.8)
Константа равновесия для этой реакции имеет вид:
 (2.9)
(2.9)
Тогда фосфатную емкость представляют в виде выражения:
 (2.10)
(2.10)
Однако, осуществить процесс дефосфорации в окислительных условиях для высоколегированных расплавов, как отмечалось выше, не представляется возможным, в связи с чем рассмотрим дефосфорацию в восстановительных условиях /4/. В этом случае в ионной форме процесс перехода фосфора в шлаковую фазу может быть описан реакцией:
![]() (2.11)
(2.11)
 (2.12)
(2.12)
Фосфор в левой части уравнений (2.8) и (2.11) принят в виде газообразного фосфора, несмотря на то, что рассматривается переход его из металлической в шлаковую фазу. Это принято для пояснения описания выражения фосфатной емкости флюса.
В данном случае характеристикой сорбционной способности флюса по отношению к фосфору является фосфидная емкость, которая может быть представлена выражением (2.13):
![]()
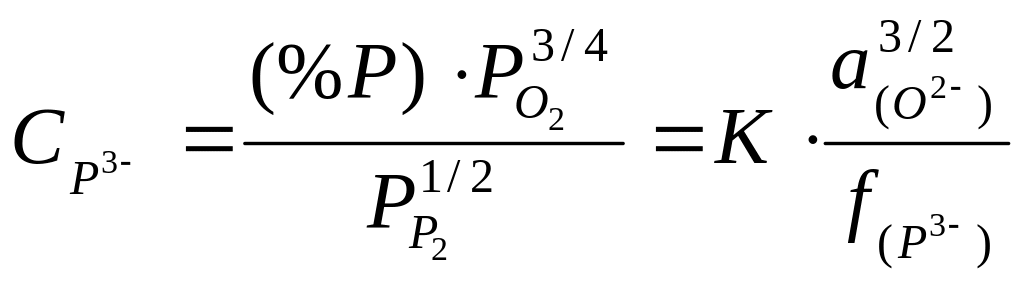 (2.13)
(2.13)
Окисленность системы, при которой осуществима дефосфорация металлического расплава в восстановительных условиях, в основном зависит от состава флюса и температуры. Для флюсов CaO-CaF2, СаО-Аl2О3, например, заметная дефосфорация наблюдается при окислительном потенциале, характеризующемся < 10-18 атм. Представляются весьма перспективными предложения по использованию флюсов на основе Са-СаF2. Для снижения стоимости выше указанного флюса он может быть заменен на более дешевый с основой в виде карбида кальция. В этом отношении представляются весьма перспективные разработки кафедры электрометаллургии стали и ферросплавов МИСиС по рафинированию высоколегированных расплавов жидким флюсом на базе карбида кальция.
Дефосфорацию при окисленности системы в пределах от 10-11 -10-12 до 10-15-10-16 принято считать дефосфорацией в слабоокислительных условиях. Это позволяет уменьшить окисление легирующих элементов и весьма заметно снизить концентрацию фосфора в металле. Например, для коррозионностойкой стали максимальный уровень окисленности расплава, позволяющий сохранить хром в металле, соответствует <10-12 атм и может быть определен из реакции (2.14),
(Сr3O4)тв =3[Cr]+2O2 (2.14)
Следовательно, дефосфорацию необходимо проводить в этих условиях. Тогда в качестве флюса целесообразно использовать, например, оксидную смесь в виде СаО-ВаО-Сr2О3. Если в качестве окислителя в смеси присутствует оксид железа, то его доля не должна приводить к переокислению расплава.
Для высокомарганцевых сталей уровень окисленности, при котором возможно проводить дефосфорацию в слабоокислительных условиях, должен определяться реакцией диссоциации оксида марганца (2.15)
![]() (2.15)
(2.15)
Для стали 110Г13Л только при окисленности системы, характеризующейся < 10-13 -10-12,5 атм., можно рассматривать и предлагать способы дефосфорации расплава и в слабоокислительных, и в восстановительных условиях.
В эти же периоды удаляется и углерод. Остановимся на некоторых закономерностях этого процесса.
