
- •1 Вопрос Кинематика точки. Путь. Перемещение. Скорость и ускорение. Их проекции на координатные оси. Вычисление пройденного пути. Средние значения.
- •3 Вопрос Скорость точки при векторном способе задания движения.
- •4 Вопрос Скорость и ускорение при криволинейном движении. Тангенциальное и нормальное ускорения.
- •5 Вопрос Движения Материальной Точки по Окружности
- •Рассмотрим бесконечно малый промежуток времени Δt → 0, за который твердое тело совершает поворот на бесконечно малый угол Δα вокруг мгновенной оси ω
- •23 Вопрос Закон сохранения энергии в механике
- •Вопрос 25 Теорема Гюйгенса-Штейнера
- •Вопрос 27
- •Вопрос 29,30 Гидродинамика. Линии тока. Уравнение Бернулли.
- •Вопрос 31,32 Ламинарное и турбулентное течение жидкости. Сила вязкого трения в жидкости. Число Рейнольдса. Формула Пуазейля.
- •Вопрос 38
- •Вопрос 40
- •Вопрос 41
- •Вопрос 42 Барометрическая формула. Закон Больцмана для распределения частиц во внешнем потенциальном поле.
- •Вопрос 44, 45 .Приминение первого начала термодинамики к изопроцессам и адиабатному процессу идеального газа. Зависимость теплоёмкости идеального газа от вида процесса.
- •Вопрос 46
- •Вопрос 49, 51, 54
- •Вопрос 52
- •Вопрос 59
- •Вопрос 47 Политропные процессы
- •Уравнение процесса
- •Вопрос 50
Вопрос 31,32 Ламинарное и турбулентное течение жидкости. Сила вязкого трения в жидкости. Число Рейнольдса. Формула Пуазейля.
Ламинарное течение — течение, при котором жидкость или газ перемещается слоями без перемешивания и пульсаций (то есть беспорядочных быстрых изменений скорости и давления).
Ламинарное
течение возможно только до некоторого
критического значения числа Рейнольдса,
после которого оно переходит в
турбулентное. Критическое значение
числа Рейнольдса зависит от конкретного
вида течения (течение в круглой трубе,
обтекание шара и т. п.). Например,
для течения в круглой трубе
![]() .
.
Турбулентность — явление, заключающееся в том, что при увеличении интенсивности течения жидкости или газа в среде самопроизвольно образуются многочисленные нелинейные фрактальные волны и обычные, линейные различных размеров, без наличия внешних, случайных, возмущающих среду сил и/или при их присутствии. Для расчёта подобных течений были созданы различные модели турбулентности.
Сила вязкого трения
Сила вязкого трения пропорциональна скорости относительного движения V тел, пропорциональна площади S и обратно пропорциональна расстоянию между плоскостями h.
![]()
Коэффициент пропорциональности, зависящий от сорта жидкости или газа, называют коэффициентом динамической вязкости. Самое важное в характере сил вязкого трения то, что тела придут в движение при наличии сколь угодно малой силы, то есть не существует трения покоя. Это отличает вязкое трение от сухого.
Число Рейнольдса
Число Рейнольдса — безразмерное соотношение, которое, как принято считать, определяет ламинарный или турбулентный режим течения жидкости или газа. Число Рейнольдса также считается критерием подобия потоков.
Число
Рейнольдса определяется следующим
соотношением:
![]() ,
где ρ — плотность
среды, v
— характерная скорость,
l
— характерный размер, μ — динамическая
вязкость
среды.
,
где ρ — плотность
среды, v
— характерная скорость,
l
— характерный размер, μ — динамическая
вязкость
среды.
Переход от ламинарного к турбулентному режиму происходит по достижении так называемого критического числа Рейнольдса Rekp. При Re < Rekp течение происходит в ламинарном режиме, при Re > Rekp возможно возникновение турбулентности. Критическое значение числа Рейнольдса зависит от конкретного вида течения (течение в круглой трубе, обтекание шара и т. п.). Например, для течения в круглой трубе .
Число Рейнольдса как критерий перехода от ламинарного к турбулентному режиму течения и обратно относительно хорошо действует для напорных потоков. При переходе к безнапорным потокам переходная зона между ламинарным и турбулентным режимами возрастает, и использование числа Рейнольдса как критерия не всегда правомерно.
Формула Пуазейля
 Эта
формула служит для количественного
описания процессов ламинарного течения
вязкой жидкости в цилиндрической трубе
постоянного сечения, где V - объем вязкой
жидкости, L- длина участка трубы, r - ее
радиус, t - время истечения жидкости, (Р1
- Р2) - перепад давлений, h - вязкость.
Эта
формула служит для количественного
описания процессов ламинарного течения
вязкой жидкости в цилиндрической трубе
постоянного сечения, где V - объем вязкой
жидкости, L- длина участка трубы, r - ее
радиус, t - время истечения жидкости, (Р1
- Р2) - перепад давлений, h - вязкость.
 Разделив
обе части этого выражения на время
истечения t, слева получим объемную
скорость
течения жидкости Q. Величину 8hL / p r4
обозначим через X. Тогда формула Пуазейля
принимает вид:
Разделив
обе части этого выражения на время
истечения t, слева получим объемную
скорость
течения жидкости Q. Величину 8hL / p r4
обозначим через X. Тогда формула Пуазейля
принимает вид:
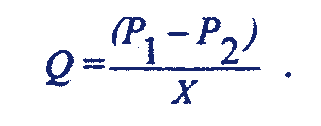
Величина Q определяется в основном радиусом сосуда r. Это обусловлено главным образом тем, что кровоток пропорционален четвертой степени r, но так же и тем, что другие члены уравнения, например, разность давлений или длина для данного сосуда остается при обычных обстоятельствах примерно постоянной. Такая запись аналогична закону Ома для участка электрической цепи. С помощью формулы Пуазейля можно определить ряд характеристик кровотока. Так, зная объемную скорость кровотока Q и величину гидравлического сопротивления сосудов, можно найти величину давления крови в любой точке сосудистой системы. Если Ро - давление крови в желудочке сердца, а X - общее сопротивление сосудов на участке сосудистой системы между желудочком и данной точкой, то давление крови Р в данной точке равно:
Р = Ро - QX .
Закон Пуазейля не используют для объяснения процессов, протекающих в сосудистой системе, так как кровеносные сосуды не имеют жестких стенок, а кровь не является вязкой гомогенной жидкостью, но он может быть полезен для понимания качественных закономерностей.
Вопрос 35 Для объяснения свойств вещества в газообразном состоянии используетсямодель идеального газа. В этой модели газ рассматривается в виде совокупности молекул — шариков очень малых размеров и почти не взаимодействующих между собой, т.е. при рассмотрении законов идеального газа пренебрегают собственным объемом молекул (по сравнению с объемом сосуда, в котором он находится) и силами их взаимного притяжения; при соударениях молекул друг с другом и со стенками сосуда действуют силы упругого отталкивания.Идеального газа в природе не существует — это упрощенная модель реального газа.
Массы атомов и молекул малы и составляют величины порядка 10-26 кг (так, масса молекулы воды составляет 3·10-26 кг). Поэтому для характеристики масс атомов и молекул применяются безразмерные величины, получившие название относительной атомной массы элемента и относительной молекулярной массы вещества.
Массы атомов и молекул малы и составляют величины порядка 10-26 кг (так, масса молекулы воды составляет 3·10-26 кг). Поэтому для характеристики масс атомов и молекул применяются безразмерные величины, получившие название относительной атомной массы элемента и относительной молекулярной массы вещества. Относительной атомной массой (Ar) элемента называется отношение массы атома этого элемента к 1/12 массы атома 12С. Относительной молекулярной массой (Mr) вещества называется отношение массы молекулы этого вещества к 1/12 массы атома 12С. Масса, равная 1/12 массы атома 12С, называется атомной единицей массы (а.е.м.). Обозначим ее mед. Тогда масса атома будет равна Ar·mед, а масса молекулы - Mr·mед. Макроскопическая система должна содержать число частиц сравнимое с числом Авогадро, чтобы ее можно было рассматривать в рамках статистической физики. Числом Авогадро называется число атомов, содержащихся в 12 граммах углерода: NA=6,022·1023 (2) Отношение числа молекул N в макрообъекте к числу Авогадро NA называют количеством вещества: ν=N/NA (3) В качестве единицы количества вещества используется моль, то есть количество вещества, которое содержит столько же частиц (атомов, молекул, ионов), сколько атомов содержится в 12 граммах углерода. Поэтому размерность числа Авогадро - моль-1. Масса одного моля вещества называется молярной массой M. Молярная масса M связана с массой одной молекулы m0 соотношением:M=m0·NA (4) и измеряется в кг/моль. Если m - масса всего вещества, то количество вещества ν в молях равно:ν=m/M (5) Объем одного моля газа (V1) при нормальных условиях (давление p1=101,3 кПа; температура T1=273 К) составляет 22,4·10-3 м3 . Поэтому число молей газа, содержащихся в объеме V, можно записать и так: ν=V/V1 (6) |
Вопрос
36 Опытное
обоснование основных положений
молекулярно-кинетической теории (МКТ)
строения вещества. Масса и размер
молекул. Постоянная
Авогадро.
Молекулярно-кинетическая
теория — это раздел физики, изучающий
свойства различных состояний вещества,
основывающийся на представлениях о
существовании молекул и атомов как
мельчайших частиц вещества. В основе
МКТ лежат три основных положения:
1. Все вещества состоят из мельчайших
частиц: молекул, атомов или ионов.
2.
Эти частицы находятся в непрерывном
хаотическом движении, скорость которого
определяет температуру вещества.
3. Между частицами существуют силы
притяжения и отталкивания, характер
которых зависит от расстояния между
ними.
Основные
положения МКТ подтверждаются многими
опытными фактами. Существование молекул,
атомов и ионов доказано экспериментально,
молекулы достаточно изучены и даже
сфотографированы с помощью электронных
микроскопов. Способность газов
неограниченно расширяться и занимать
весь предоставленный им объем объясняется
непрерывным хаотическим движением
молекул. Упругость газов, твердых и
жидких тел, способность жидкостей
смачивать некоторые твердые тела,
процессы окрашивания, склеивания,
сохранения формы твердыми телами и
многое другое говорят о существовании
сил притяжения и отталкивания между
молекулами. Явление диффузии — способность
молекул одного вещества проникать в
промежутки между молекулами другого —
тоже подтверждает основные положения
МКТ. Явлением диффузии объясняется,
например, распространение запахов,
смешивание разнородных жидкостей,
процесс растворения твердых тел в
жидкостях, сварка металлов путем их
расплавления или путем давления.
Подтверждением непрерывного хаотического
движения молекул является также и
броуновское движение — непрерывное
хаотическое движение микроскопических
частиц, нерастворимых в жидкости.
Движение броуновских частиц объясняется
хаотическим движением частиц жидкости,
которые сталкиваются с микроскопическими
частицами и приводят их в движение.
Опытным путем было доказано, что скорость
броуновских частиц зависит от температуры
жидкости. Теорию броуновского движения
разработал А. Эйнштейн. Законы движения
частиц носят статистический, вероятностный
характер. Известен только один способ
уменьшения интенсивности броуновского
движения — уменьшение температуры.
Существование броуновского движения
убедительно подтверждает движение
молекул.
Любое вещество состоит из частиц,
поэтому количество вещества v принято
считать пропорциональным числу частиц,
т. е. структурных элементов, содержащихся
в теле.
Единицей количества вещества является
моль. Моль — это количество вещества,
содержащее столько же структурных
элементов любого вещества, сколько
содержится атомов в 12 г углерода С12.
Отношение числа молекул вещества к
количеству вещества называют постоянной
Авогадро: ![]() Постоянная Авогадро показывает, сколько
атомов и молекул содержится в одном
моле вещества. Молярная масса — масса
одного моля вещества, равная отношению
массы вещества к количеству вещества:
М = m/v.
Молярная масса выражается в кг/моль.
Зная молярную массу, можно вычислить
массу одной молекулы:
Постоянная Авогадро показывает, сколько
атомов и молекул содержится в одном
моле вещества. Молярная масса — масса
одного моля вещества, равная отношению
массы вещества к количеству вещества:
М = m/v.
Молярная масса выражается в кг/моль.
Зная молярную массу, можно вычислить
массу одной молекулы: ![]() Средняя масса молекул обычно определяется
химическими методами, постоянная
Авогадро с высокой точностью определена
несколькими физическими методами. Массы
молекул и атомов со значительной степенью
точности определяются с помощью
масс-спектрографа.
Массы молекул очень малы. Например,
масса молекулы воды:
Средняя масса молекул обычно определяется
химическими методами, постоянная
Авогадро с высокой точностью определена
несколькими физическими методами. Массы
молекул и атомов со значительной степенью
точности определяются с помощью
масс-спектрографа.
Массы молекул очень малы. Например,
масса молекулы воды: ![]() Молярная масса связана с относительной
молекулярной массой Мг. Относительная
молекулярная масса — это величина,
равная отношению массы молекулы данного
вещества к 1/12 массы атома углерода С12.
Если известна химическая формула
вещества, то с помощью таблицы Менделеева
может быть определена его относительная
масса, которая, будучи выражена в
килограммах, показывает величину
молярной массы этого вещества.
Диаметром молекулы принято считать
минимальное расстояние, на которое им
позволяют сблизиться силы отталкивания.
Однако понятие размера молекулы является
условным. Средний размер молекул порядка
10^-10м.
Молярная масса связана с относительной
молекулярной массой Мг. Относительная
молекулярная масса — это величина,
равная отношению массы молекулы данного
вещества к 1/12 массы атома углерода С12.
Если известна химическая формула
вещества, то с помощью таблицы Менделеева
может быть определена его относительная
масса, которая, будучи выражена в
килограммах, показывает величину
молярной массы этого вещества.
Диаметром молекулы принято считать
минимальное расстояние, на которое им
позволяют сблизиться силы отталкивания.
Однако понятие размера молекулы является
условным. Средний размер молекул порядка
10^-10м.
Вопрос 37 С точки зрения МКТ молекулоы, налетая на стенку, изменяют направление своего движения, то есть у них изменяется импульс. Вот это изменение и передаётся стенкам сосуда. А одинаково оно потому, что распределение скоростей молекул по направлениям сферически симметрично (попросту говоря - им по фигу, лететь вверх или вбок или ещё как-то). Поэтому оказываемое ими давление не зависит от ориентации поверхности. Точное исследование давления смеси газов впервые произведено в 1809 г. английским химиком Джоном Дальтоном (1766—1844). Давление, которое будет иметь каждый из газов, составляющих смесь, если удалить остальные газы из объема, занимаемого смесью, называют парциальным давлением этого газа (от латинского слова pars — парциальный, частичный). Дальтон нашел, что давление смеси газов равно сумме их парциальных давлений (закон Дальтона). Если, например, давление кислорода в колбе равно 400 мм рт. ст., а давление водорода в такой же колбе при той же температуре равно 300 мм рт. ст., то, смешав те же массы кислорода и водорода в такой же колбе (и при той же температуре), получим смесь при давлении 400 мм рт. ст.+300 мм рт. ст.=700 мм рт. ст. Заметим, что к сильно сжатым газам закон Дальтона неприменим, так же как и 8акон Бойля — Мариотта.
