
- •Лекция № 17. Гидроксикислоты Пространственное строение органических молекул
- •Соон соон соон соон
- •Лекция № 17.
- •Алифатические гидроксикислоты.
- •Реакции карбоксильной группы
- •Молочная Метиллактат
- •Реакции гидроксильной группы
- •Специфические свойства
- •Β сн2 сн2 группа
- •Отдельные представители Молочная (2 – гидроксипропановая) кислота сн3с*н(он) соон.
- •Яблочная (гидроксибутандиовая) кислота ноосс*н(он)сн2соон.
- •Соон кислота
Молочная Метиллактат
кислота
При взаимодействии с галогенидами фосфора гидроксикарбоновые кислоты превращаются в галогенангидриды. При этом спиртовая гидроксильная группа также замещается на галоген.
О O
СН2 – СН2 – С + 2PCI5 СН2 – СН2 – С + 2POCI3 + НCI
ОН CI
ОН CI
3 – Гидроксипропановая Хлорангидрид
кислота 3-хлорпропановой кислоты
Реакции гидроксильной группы
При ацилировании гидроксикарбоновых кислот галогенангидридами получаются сложные эфиры. Для ацилирования можно использовать и ангидриды кислот.
О
СН2 – СООН + СН3 – С СН3 – С – О – СН2 – СOОН + НCI
 CI
CI
ОН О
Гидроксиуксусная Ацетилхлорид О – Ацетилгликолевая
кислота кислота
При взаимодействии с галогеноводородами (HCI, HBr) происходит нуклеофильное замещение спиртовой гидроксильной группы на галоген и получаются галогенозамещенные кислоты. Так как карбоксильная группа в этих условиях не реагирует с галогеноводородами, то галогенангидрид в этой реакции не образуется:
СН3 – СН – СООН + HBr СН3 – СН – СООН + Н2O
ОН Br
2 – Бромпропановая
кислота
При окислении гидроксикислот получаются оксокарбоновые кислоты (альдегидо- и кетонокислоты).
Н
О [О] Н O
НО – С – С С – С
ОН О ОН
Н
Гликолевая кислота Глиоксиловая кислота
Специфические свойства
Наряду с тем, что каждая из функциональных групп гидроксикарбоновых кислот проявляет присущие ей химические свойства, у этих соединений появляются специфические свойства, обусловленные одновременным присутствием в молекуле двух разных функциональных групп. Химические поведение гидроксикислот сильно зависит от взаимного расположения функциональных групп. Поэтому γ, β, α – гидроксикислоты, различающиеся степенью удаления гидроксильной группы от карбоксильной, при нагревании подвергаются разным превращениям.
α – Гидроксикислоты при нагревании вступают в реакцию этерификации, происходящую между двумя молекулами, т. е. межмолекулярно. При этом спиртовая гидроксильная группа одной молекулы реагирует с карбоксильной группой другой молекулы и наоборот. Образующиеся сложные эфиры имеют циклическое строение и содержат в молекуле две сложноэфирные группы. Такие соединения называются лактидами. Образование лактидов характерно только для α – гидроксикислот, так как лишь в этом случае возникает устойчивый шестичленный цикл. Лактиды способны гидролизоваться с образованием исходных кислот.
О О
 С – ОН Н – О
С – О
Сложно-
С – ОН Н – О
С – О
Сложно-
С Н3 – СН + СН – СН3 СН3 – СН СН – СН3 эфирные
О – Н НО – С -2Н2О О – С группы
О О
Молочная кислота Лактид
β – Гидроксикислоты при нагревании вступают в реакцию дегидратации с образованием α, β – ненасыщенных карбоновых кислот. Склонность β – гидроксикислот к элиминированию молекулы воды обусловлена подвижностью водорода у α – атома углерода (СН – кислотный центр), связанного с двумя электроноакцепторными группировками.
СН – Кислотный
центр
 β
α
β
α
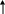
 СН3
СН2
СН СООН СН3
– СН = СН – СООН
- Н2О
СН3
СН2
СН СООН СН3
– СН = СН – СООН
- Н2О
ОН Н
3 – Гидроксибутановая кислота Бутен – 2 – овая кислота
γ и δ – Гидроксикислоты уже при комнатной температуре легко вступают в реакцию этерификации. При этом сложный эфир образуется за счет взаимодействия между гидроксильной и карбоксильной группами одной и той же молекулы, т. е. внутримолекулярно. Образующийся сложный эфир содержит в отличие от лактидов одну сложноэфирную группу, но также имеет циклическое строение. Такие соединения называются лактонами.
α δ+ О O
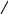 СН2
– С СН2
– С
СН2
– С СН2
– С

 ОН
t
Амидная
ОН
t
Амидная
