
- •Скорость. Мгновенная скорость. Ускоренное и равномерное движение. Движение по окружности с постоянной скоростью.
- •Взаимодействие тел. Масса тела. Законы динамики Ньютона.
- •Вес и невесомость.
- •Сила упругости. Сила трения.
- •Импульс силы. Импульс тела. Закон сохранения импульса. Проявление закона сохранения импульса в природе и его применение в технике.
- •Механическая работа. Кинетическая энергия.
- •Потенциальная энергия. Закон сохранения энергии в механических процессах
- •Плотность вещества. Удельный вес. Единицы измерения.
- •10.Основные положения мкт и их опытные обоснования.
- •11.Давление газа. Основное уравнение мкт идеального газа.
- •12.Температура и её измерение. Абсолютная температура.
- •13.Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона). Изопроцессы.
- •29. Электрический ток в полупроводниках. Собственная и примесная проводимость полупроводников. Полупроводниковые приборы.
- •30. Электрический ток в электролитах. Электрохимическая диссоциация. Закон Фарадея. Применение электролиза.
- •Что такое электролиз и где его применяют
- •Первый Закон Фарадея
- •31. Электрический ток в газах. Самостоятельный и несамостоятельный заряды.
- •Термическая ионизация
- •Фотоионизация
- •Самостоятельный электрический разряд
- •Ионизация электронным ударом
- •Механизм самостоятельного разряда
- •Искровой разряд. Молния
- •Тлеющий разряд
- •Электрическая дуга.
- •Коронный разряд
- •32. Электрический ток в вакууме. Вакуумный диод.
- •Термоэлектронная эмиссия
- •Вольтамперная характеристика вакуумного диода.
- •33. Магнитное поле, условия его существования. Опыт Эрстеда. Магнитное поле прямого тока, кругового тока и соленоида. Правило буравчика.
- •Геометрическая оптика. Луч. Законы отражения и преломления света.
- •Дисперсия света. Спектры электромагнитных излучений. Спектральный анализ и его применение. (?)
- •Ультрафиолетовая и инфракрасная часть спектра, их роль в природе и применение в технике. (?)
Первый Закон Фарадея
Явление электролиза было изучено Майклом Фарадеем. Он установил, что масса вещества, выделяющегося при электролизе, прямо пропорциональна количеству электричества, протекшего через раствор:
m = kq
Опыты Фарадея показали, что масса выделенного при электролизе вещества зависит не только от величины заряда q, но и от рода вещества.
Объясняем, почему. Положительно заряженный ион, из раствора радостно направляющийся к отрицательно заряженному аноду, для того, чтобы осесть на нём в виде полноценного атома своего вещества, должен разрядиться, т.е. присоединить себе недостающие электроны. Для разных веществ нужно разное количество. Следовательно, заряд, перенесённый через электролит при прохождении тока, должен быть прямо пропорционален числу разрядившихся ионов. Поскольку массы ионов определённого рода вещества точно одинаковы, то их общая масса пропорциональна их числу. А это означает, что масса выделенного вещества прямо пропорциональна заряду, прошедшему через раствор, что соответствует закону Фарадея. Поскольку ионы разных веществ имеют разную массу, то и коэффициент пропорциональности у каждого вещества свой.
Коэффициент пропорциональности k, выражающий зависимость массы выделенного пи электролизе вещества от его рода, называют электрохимическим эквивалентом вещества. Электрохимический эквивалент измеряется массой вещества, выделяющегося на электроде при прохождении через электролит единицы заряда:
K=m/q
В системе СИ единицей электрохимического эквивалента k является 1кг/Кл
Так как q=It, то 1 закон Фарадея можно записать след. образом:
m=kIt
Второй закон Фарадея:
для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорционально эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
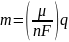
Химический
эквивалент иона – это частное от деления молекулярной
массы вещества на его валентность. Проще
говоря, химический эквивалент – это
отношение массы 1 иона к количеству
вещества моль.
Например, химический эквивалент меди
= 31,7 г/моль, т. к мы поделили отн.атомную
массу меди 63,54 г/моль на её валентность
– 2.
– это частное от деления молекулярной
массы вещества на его валентность. Проще
говоря, химический эквивалент – это
отношение массы 1 иона к количеству
вещества моль.
Например, химический эквивалент меди
= 31,7 г/моль, т. к мы поделили отн.атомную
массу меди 63,54 г/моль на её валентность
– 2.
Постоянная Фарадея (F=9,65*10000 Кл/моль) показывает, какое количество электричества нужно пропустить через электролит для выделения на одном из электродов одного химического эквивалента.
А q – это, собственно, заряд.
31. Электрический ток в газах. Самостоятельный и несамостоятельный заряды.
Несамостоятельный электрический разряд.
Опыт показывает, что две разноименно заряженные пластины, разделенные слоем воздуха, не разряжаются. Обычно вещество в газообразном состоянии является изолятором, так как атомы или молекулы, из которых оно состоит, содержат одинаковое число отрицательных положительных электрических зарядов и в целом нейтральны.
Внесем в пространство между пластинами пламя спички или спиртовки.
При этом электрометр начнет быстро разряжаться. Следовательно, воздух под действием пламени стал проводником. При вынесении пламени из пространства между пластинами разряд электрометра прекращается. Такой же результат можно получить, облучая пластины светом электрической дуги. Эти опыты доказывают, что газ может стать проводником электрического тока.
Явление прохождения электрического тока через газ, наблюдаемое только при условии какого-либо внешнего воздействия, называется несамостоятельным электрическим разрядом.
