
- •1.Основные понятия химии:
- •2.Качественный и количественный состав вещества. Молярный объем. Число Авогадро.
- •4.Эквивалент и молярная масса эквивалента (эквивалентная масса) простых и сложных веществ. Молярный объем эквивалента (эквивалентный объем). Закон эквивалентов.
- •Вопрос 6
- •20. Реакции ионного обмена в растворах электролитов. Условия практической необратимости протекания реакций ионного обмена.
- •21.Малорастворимые электролиты. Равновесие в системе осадок – раствор. Произведение растворимости. Условия образования и растворения осадков. Образование осадков и элементы качественного анализа.
- •22.Жесткость воды. Временная и постоянная жесткость. Методы снижения жесткости воды.
- •24.Гидролиз. Гидролиз солей. Количественные характеристики процесса гидролиза. Степень гидролиза и константа гидролиза. Смещение равновесия процесса гидролиза. Необратимый гидролиз.
- •25. Окислительно-восстановительные реакции. Степень окисления элемента. Окислитель и восстановитель. Процессы окисления и восстановления. Приведите примеры типичных окислителей и восстановителей.
- •Вопрос 28
- •Вопрос 29
- •40Ненашёл
- •Щелолчные и щелочноземельные металлы.
- •68 Вопрос
- •69 Билет
- •Вопрос 70
- •Вопрос 71
24.Гидролиз. Гидролиз солей. Количественные характеристики процесса гидролиза. Степень гидролиза и константа гидролиза. Смещение равновесия процесса гидролиза. Необратимый гидролиз.
Гидролиз – это разложение водой. Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов.
Поскольку соль состоит из катиона и аниона, то возможны три типа гидролиза:
• гидролиз по катиону (в реакцию с водой вступает только катион); • гидролиз по аниону (в реакцию с водой вступает только анион); • совместный гидролиз (в реакцию с водой вступает и катион, и анион).
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр); α = (cгидр/cобщ)·100 % где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли. Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза- константа равновесия гидролитической реакции.
В общем случае для соли, образованной слабой кислотой и сильным основанием:
![]() ,
где
,
где ![]() —
константа
диссоциации слабой кислоты, образующейся
при гидролизе
—
константа
диссоциации слабой кислоты, образующейся
при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
![]() ,
где
,
где ![]() —
константа
диссоциации слабого основания,
образующегося при гидролизе
—
константа
диссоциации слабого основания,
образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:
![]()
Гидролиз солей — обратимый процесс. Для него, как и для любой другой обратимой реакции, характерно состояние равновесия, которое может смещаться по принципу Ле-Шателье. Например, если подкислять раствор соли NH4Cl, то равновесие сместится в левую сторону, то есть гидролиз замедлится.
Для большинства солей гидролиз является обратимым процессом, однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз – необратимый процесс. Необратимому гидролизу подвергаются соли, образованные слабым нерастворимым или летучим основанием и слабой нерастворимой или летучей кислотой. Такие соли не могут существовать в водных растворах (Аl2S3, Fe2(СО3)3 и т.п.),
25. Окислительно-восстановительные реакции. Степень окисления элемента. Окислитель и восстановитель. Процессы окисления и восстановления. Приведите примеры типичных окислителей и восстановителей.
Реакции, протекающие с изменением степени окисления, называются окислительно-восстановительными реакциями.
Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается.
Типичные окислители:
F2, Cl2, Br2, I2, O2, H2SO4, HNO3,
MnO2, KMnO4, K2CrO4, NaClO.
Типичные восстановители:
Н2, C, металлы, Н2S, CO, SO2, HI, FeSO4.
26.Классификация окислительно-восстановительных реакций. Приведите примеры реакций каждого типа. Составьте уравнения соответствующих реакций с помощью метода электронного баланса.
Классификация:
1.Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
H2S+Cl2->S+2HCl
2.Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H20-->2H2+O2
3.Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 +H20→ HClO + HCl
4.Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4N03→N20+2H20
Пример метода электронного баланса:
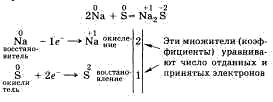
27.Характер взаимодействия металлов с водой, растворами солей, щелочей и кислот. Особенности взаимодействия металлов с концентрированной серной кислотой и азотной кислотой. Как реагирует железо с сильно разбавленной, разбавленной и концентрированной азотной кислотой? Составьте уравнения соответствующих реакций.
Важные химические свойства металлов проявляются в их отношении к воде, растворам кислот, щелочам, солям.
При рассмотрении взаимодействия металлов с кислотами необходимо учитывать концентрацию кислот и активность металлов.

Щелочи взаимодействуют только с металлами, оксиды которых проявляют амфотерный характер.

Более активные металлы вытесняют менее активные из растворов их солей.

Взаимодействие металлов с разбавленной и концентрированной азотной кислотой. В азотной кислоте окислителем является нитрат – анион NO3–. Характерная особенность азотной кислоты состоит в том, что при её действии на металлы обычно не происходит выделения газообразного водорода. При восстановлении нитрат –аниона степень окисления азота уменьшается с +5 до +4, +3, +2, +1, 0, или даже –3. При этом образуются различные оксиды азота или нитрат аммония. Степень окисления азота также зависит от концентрации кислоты и активности металла.
При взаимодействии металлов с концентрированной серной кислотой следует иметь в виду, что окислителем является сульфат-анион SO42–. А не ион Н+, какуэто имеет место в реакциях металлов с обычными кислотами. При восстановлении концентрированной серной кислиты степень окисления серы уменьшается от +6 до +4, или –2. Это зависит от активности металла, то есть от его электродного потенциала. Так, в случае неактивного металла (Ео>–0,5 В) сера восстанавливается до +4 (SO2), а в случае активного металла (Ео < –0,5 В) сера восстанавливается до 0 (S) или –2 (H2S).
С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
![]()
![]()
