
- •Билет №20 «Волновая функция.Уравнение Шредингера.Стационарное состояние»
- •Билет№21 «Частица в одномерной прямоугольной потенциальной яме.Прохождение частицы через потенциальный барьер»
- •Билет№22 «Атом водорода.Потенциалы возбуждения и ионизации.Квантовые числа.Вырожденные состояния»
- •Билет №23 «Ширина спектральных линий.Мультиплетность спектров.Спин электрона.Магнетон Бора»
- •Билет №24 «Спин орбитальное взаимодействие.Эффект Зеемана.Принцип Паули.Расположение элементов в системе Меделеева»
- •Билет №25 «Ионная и ковалентная связи атомов в молекуле.Энергия диссоциации.Полная энергия молекулы.Вращательные ,колебательно-вращательные полосы»
- •Билет №7 «Дифракция от круглого сечения,круглого диска ,щели»
- •Билет №26 «Вынужденное излучение .Мазеры. Лазеры. Накачка метастабильных уровней. Свойства лазерного излучения»
- •1. Лазерное излучение когерентно и практически монохроматично. 2. Лазерное излучение большой мощности имеет огромную температуру.
- •Билет №27 «Фазовое пространство.Функция распределения.Понятие о квантовой статистике Бозе-Эйнштейна и Ферми-Дирика»
- •Билет №28 «Колебания кристаллической решетки.Теория Дебая теплоемкости кристаллов.Энергия нулевых колебаний.»
- •Билет №29 «Квантовая теория свободных электронов в металле.Уровень Ферми.Запрещенные зоны.Валентная зона.Зона проводимости»
- •Билет №3 «Фотометрические величины.Интенсивность,световой поток,поверхностная яркость,освещенность»
- •Билет №4 «Принцип Гюйгенса.Когерентные волны.Интерференция света.Оптическая разность хода»
- •Билет №5 «Полосы равного наклона и равной толщины.Кольца Ньютона.Инерферометры Майкельсона и Фабри-Перо»
- •Билет №6 «Дифракция Фраунгофера и дифракция Френеля.Принцип Гюйгенса-Френеля.Зоны Френеля»
- •Билет №7 «Дифракция от круглого сечения,круглого диска ,щели»
- •Билет №7 «Дифракция от круглого сечения,круглого диска ,щели»
- •Билет №40 «Реакция деления ядра.Цепная реакция деления»
- •Билет №30 «Электропроводность металлов.Сверхпроводимсоть.Температурные зависимости проводимости»
- •Билет №31 «Дырочня проводимость.ПРимесная проводимость.Зпрещенные зоны.Валентная зона.Зона проводимости»
- •Билет №32 «Работа выхода.Термоэлектронная эмиссия.Контактная разность потенциалов»
- •Билет №33 «Контактные явления в полупроводниках»
- •Билет №34 «Термоэлектрические явления»
- •1. Явление Зеебека. В замкнутой цепи, состоящей из последовательно соединенных разнородных проводников, контакты между которыми имеют различную температуру, возникает электрический ток.
- •Билет №35 «Основные свойства атомного ядра»
- •Билет №36 «Масса и энергия связи.Дефект массы.Деление тяжелых и синтез легких ядер»
- •Билет №37 «Ядерные силы.Модели ядра.Мезоны»
- •Билет №38 «Радиоактивность.Постоянная распада.Альфа,бета и гамма-излучения»
Билет№22 «Атом водорода.Потенциалы возбуждения и ионизации.Квантовые числа.Вырожденные состояния»
Решение задачи об энергетических уровнях электрона для атома водорода (а также водородоподобных систем: иона гелия Не+, двукратно ионизованного лития Li++ и др.) сводится к задаче о движении электрона в кулоновском поле ядра.
Состояние электрона
в атоме водорода описывается волновой
функцией ,
удовлетворяющей стационарному уравнению
Шредингера (217.5), учитывающему значение
(223.1):
![]() (223.2)
(223.2)
где т — масса
электрона, Е — полная энергия электрона
в атоме. Так как поле, в котором движется
электрон, является центрально-симметричным,
то для решения уравнения (223.2) обычно
используют сферическую систему
координат: r,
,
Как и в случае «потенциальной ямы» с
бесконечно высокими «стенками» и
гармонического осциллятора ,решение
уравнения Шредингера для атома водорода
приводит к появлению дискретных
энергетических уровней. Возможные
значения Е1,
E2,
Е3,...
показаны на рис. 302 в виде горизонтальных
прямых. Самый нижний уровень Е1,
отвечающий минимальной возможной
энергии, — основной, все остальные
(Еn
>Е1,
n
= 2, 3, ...) — возбужденные (см. § 212). При Е<0
движение электрона является связанным
— он находится внутри гиперболической
«потенциальной ямы». Из рисунка следует,
что по мере роста главного квантового
числа n
энергетические уровни располагаются
теснее и при n=
E
= 0. При Е>0
движение электрона является свободным;
область непрерывного спектра Е>0
(заштрихована на рис. 302) соответствует
ионизованному атому. Энергия ионизации
атома водорода равна![]()

Квантовые числа. В квантовой механике доказывается, что уравнению Шредингера (223.2) удовлетворяют собственные функции
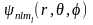 ,
определяемые тремя квантовыми числами:
главным п, орбитальным l
и магнитным тl.
,
определяемые тремя квантовыми числами:
главным п, орбитальным l
и магнитным тl.
Главное квантовое
число n,
согласно (223.3), определяет энергетические
уровни электрона в атоме и может
принимать любые целочисленные значения
начиная с единицы:
![]()
Из решения уравнения
Шредингера вытекает, что момент импульса
(механический орбитальный момент)
электрона квантуется, т. е. не может
быть произвольным, а принимает дискретные
значения, определяемые формулой![]()
где l
— орбитальное квантовое число, которое
при заданном n
принимает значения![]()
т. е. всего n значений, и определяет момент импульса электрона в атоме.
Из решения уравнений
Шредингера следует также, что вектор
Ll
момента импульса электрона может иметь
лишь такие ориентации в пространстве,
при которых его проекция Llx
на направление z
внешнего магнитного поля принимает
квантованные значения, кратные ћ:
![]() (223.6),где
тl
— магнитное
квантовое число, которое при заданном
l
может принимать значения
(223.6),где
тl
— магнитное
квантовое число, которое при заданном
l
может принимать значения![]() (223.7)т.
е. всего 2l+1
значений. Таким образом, магнитное
квантовое число ml
определяет проекцию момента импульса
электрона на заданное направление,
причем вектор момента импульса электрона
в атоме может иметь в пространстве 2l+1
ориентации.
(223.7)т.
е. всего 2l+1
значений. Таким образом, магнитное
квантовое число ml
определяет проекцию момента импульса
электрона на заданное направление,
причем вектор момента импульса электрона
в атоме может иметь в пространстве 2l+1
ориентации.
Наличие квантового числа ml должно привести в магнитном поле к расщеплению уровня с главным квантовым числом п на 2l+1 подуровней. Соответственно в спектре атома должно наблюдаться расщепление спектральных линий.
Квантовые числа п и l характеризуют размер и форму электронного облака, а квантовое число ml характеризует ориентацию электронного облака в пространстве.
