- •4.3 Окислительно-восстановительные реакции
- •4.3.1 Общие сведения об окислительно-восстановительных реакциях
- •Если в формуле (6.1 а) не использовать множитель 100%, то массовая доля будет выражена не в процентах, а в долях единицы.
- •2.1 Зависимость скорости реакции от природы реагирующих веществ
- •2.2 Зависимость скорости реакции от концентрации реагирующих веществ
- •2.3 Зависимостьскорости реакции от температуры
- •2.4 Зависимость скорости реакции от присутствия катализаторов.
- •1. Тривиальная номенклатура
- •4. Радикало-функциональная номенклатура
- •2. Физические свойства спиртов
- •3. Одноатомные предельные спирты.
- •3.1 Методы получения
- •3.2 Химические свойства предельных спиртов
- •4. Двухатомные и трехатомные спирты. Методы получения и химические свойства.
- •5. Фенолы. Общая характеристика. Методы получения и химические свойства.
- •6. Отдельные представители. Методы идентификации.
- •Общая характеристика: строение, классификация, номенклатура
- •2. Способы получения аминов
- •3. Физические свойства аминов
- •4. Химические свойства аминов
- •2. Физические свойства альдегидов и кетонов
- •3. Способы получения
- •4. Химические свойства
- •1 Общая характеристика (строение, классификация, номенклатура, изомерия).
- •Классификация и номенклатура аминокислот.
- •5. С анионобразующими группами в боковых цепях-аспарагиновая и глутаминовая кислоты:
- •Физико-химические свойства аминокислот.
- •Химические реакции аминокислот.
- •Общая характеристика: строение, и свойства белков
- •1.1 Строение белковой молекулы
- •Физико-химические свойства белков.
- •Классификация белков
- •Мальтоза
- •Целлобиоза
- •Лактоза
- •Сахароза
- •Ферментативный гидролиз крахмала и гликогена
- •2. Физические свойства карбоновых кислот
- •3. Способы получения
- •4. Химические свойства
- •Общие признаки, функции, классификация
- •Жирные кислоты
- •Омыляемые липиды
- •Простые липиды
- •Прогоркание жира
- •Сложные липиды Фосфолипиды
- •Гликолипиды
- •Неомыляемые липиды
- •Стероиды
- •Терпены
№1
В содержание химии как учебного предмета входит: а) изучение основ химической науки, т. е. ее главных фактов и законов, а также ведущих теорий, объединяющих и систематизирующих научный материал и дающих ему научное объяснение, б) ознакомление учащихся с основными методами и техническими приемами химии, с главнейшими применениями ее в жизни, в) привитие ученикам практических навыков, соответствующих содержанию химической науки и необходимых для жизни и труда; г) формирование высоконравственной личности.
Цель общего химического образования — обеспечить усвоение каждым молодым человеком знаний и умений, необходимых как для использования в повседневной и трудовой деятельности, так и для получения дальнейшего химического образования.
Важнейшие основы построения курса химии
Основы (примеры). |
Для чего? Что дают? |
Методологические (теория познания). |
Обеспечивают пути (способы) перехода от незнания к знанию. |
Психолого-педагогические (теории воспитания, учения, понимания, развития). |
Обеспечивают решение задач обучающего, воспитывающего, развивающего характера. |
Научно-теоретические (научно-теоретические концепции химии). |
Обеспечивают фундамент химического образования, построение курса химии, решение задач химического образования. |
|
|
Целью изучения данного курса является:
● интеллектуальных и практических умений в области химического эксперимента, позволяющего исследовать вещество;
●умение самостоятельно приобретать и применять знания;
●осознание этапов цикла познания : опытные факты – гипотеза – эксперимент– выводы, умение осуществлять поиск на каждом этапе цикла;
●понимание структуры теоретических знаний, построения на основе данных теоретической модели, нахождения связи между качественной и количественной сторонами явлений, получение выводов, следствий, установление границ применимости;
●интереса к тому, как происходит процесс познания;
●интереса к изучению химии и проведению и химического эксперимента.
Решение задач способствует развитию логического мышления, прививает навыки самостоятельной работы. Решение задач повышенной сложности – интересный и творческий процесс, результаты его бывают оригинальными и нестандартными и способствуют самореализации ученика. Решение расчетных задач обеспечивает закрепление теоретических знаний, учит творчески применять их в различных ситуациях.
Задачи курса следующие:
● углубить знания учащихся по химии, научить их методически правильно и практически эффективно решать задачи;
дать возможность развить и реализовать свой интерес к химии;
предоставить учащимся возможность уточнить собственную готовность и способность осваивать программу химии на повышенном уровне;
создать учащимся условия для подготовки к ЕГЭ по химии, для поступления в высшие учебные заведения химического профиля.
№2
Представления о строении атома радикально изменились в 20 в. под влиянием новых теоретических идей и экспериментальных данных. Порядок значений зарядов ядер различных А. В 1911г. английским физиком Э. Резерфорд предложил ядерную модель атома, согласно с которой атом состоит из небольшого положит. заряженного ядра, в котором почти вся атомная масса сосредоточена, расположенных вокруг ядра электронов составляющих электронную оболочку атома. В то время были определены масса покоя и заряд электрона. Атом в целом электронейтрален , т. к. положит. заряд ядра компенсируется отриц. зарядом эквивалентного числа электронов. В английским 1913г. физиком Г. Мозли установил, что заряд ядра численно равен порядковому номеру элемента находящегося в периодической системе.Таким образом, заряд ядра атома стал главной характеристикой элемента.
Хим. элемент- множ-во атомов с одинаковым зарядом ядра.
Носителем положительного заряда ядра является протон. В состав ядер атомов также входят нейтроны – элементарные частицы, не имеющие электрического заряда. Число электронов равно заряду ядра, так что атом в целом электронейтрален. Размеры атома равны приблизительно 10–8 см, размеры ядра – около 10–13 – 10–12 см. Несмотря на то, что ядро по размеру в десятки тысяч раз меньше всего атома, преобладающая часть массы атома сосредоточена именно в ядре.
Согласно законам электродинамики, вращающийся вокруг ядра электрон должен был бы непрерывно излучать энергию и, в конце концов, упасть на ядро, чего в действительности не происходит. Эти противоречия модели атома по Резерфорду устранил датский физик Нильс Бор (1913 г).
Ещё до Резерфорда,в 1900 году, немецкий физик Макс Планк выдвинул гипотезу о том, что энергия волнового движения квантуется, т.е. свет излучается и поглощается не непрерывно, а дискретно,т.е. определёнными порциями–квантами. Энергия каждого кванта связана с частотой излучения ν следующей формулой:E = hν, где h–постоянная Планка(6,63710–34 Джс).
Основываясь на положении квантовой теории о дискретной природе излучения, Нильс Бор сделал вывод о том, что энергия электронов в атоме не может быть произвольной; она изменяется скачками, т.е. дискретно. Поэтому электрон в атоме может принимать не любые значения энергии, а строго определённые. Иначе говоря, энергия электрона в атоме квантована. Таким образом, в атоме возможны не любые энергетические состояния электронов, а лишь определённые, так называемые разрешённые состояния. Переход электрона из одного разрешённого состояния в другое совершается скачкообразно и сопровождается испусканием или поглощением кванта электромагнитного излучения.
Постулаты теории Бора 1. Электрон в атоме может вращаться вокруг ядра не по любым, а только по строго определённым орбитам, которые называются стационарными.
2. Двигаясь по стационарным орбитам, электрон не излучает энергии.
3. Излучение света происходит при скачкообразном переходе электрона с одной стационарной орбиты (с более высокой энергией) на другую (с более низкой энергией). При обратном переходе происходит поглощение энергии.
Несмотря на то, что применение теории Бора для расчёта спектров простейшего атома – атома водорода – дало блестящие результаты, теория Бора была внутренне противоречивой, и её не удалось успешно применить к более сложным атомам. Дальнейшее развитие теории строения атома связано с развитием квантовой механики.
Элементарные представления о квантовой механике Как известно, свет проявляет свойства как потока частиц, так и электромагнитной волны, т.е. фотоны обладают корпускулярно-волновой двойственностью. Создание квантовой механики произошло на пути обобщения представлений о корпускулярно-волновой двойственности фотона на все объекты микромира и, прежде всего, на электроны. Электрон – это не только частица, он ещё обладает и волновыми свойствами.
В связи с тем, что частицы микромира, в том числе и электрон, отличны по своим свойствам от макроскопических тел, то для описания микрочастиц нужны совсем другие представления, отличные от представлений о законах макромира. Если для описания состояния частицы в макромире необходимо знать координаты частицы и её скорость, то в микромире нельзя одновременно определить и координаты микрочастицы и её импульс (принцип неопределённости Гейзенберга). Для характеристики состояния электрона используется волновая функция . Смысл волновой функции заключается в том, что вероятность обнаружения электрона в некотором объёме пространства V выражается произведением 2V. Таким образом, квадрат волновой функции 2 выражает плотность вероятности нахождения электрона в соответствующей области пространства. Электрон можно представить себе в виде облака, распределённого по всему объёму атома. Чем больше 2 в данной точке пространства, тем больше плотность электронного облака, и тем более вероятно нахождение электрона именно в данной точке пространства.
Применение законов квантовой механики к описанию состояния электрона в атоме показывает, что состояние электрона можно описать с помощью четырёх квантовых чисел: главного, орбитального(2-ое), магнитного(3-ье) и спинового(4-го).
Главное квантовое число Энергия электрона в атоме – величина квантованная; главное квантовое число (n) характеризует возможные значения энергии электрона в атоме. Главное квантовое число может принимать любые положительные целочисленные значения: n = 1, 2, 3, 4, ... и т.д. Наименьшей энергией электрон обладает при n = 1. Более высокие значения n соответствуют более высоким значениям энергии электрона.
Главное квантовое число определяет также и размеры электронного облака. Чем больше энергия электрона, тем более удалён он от ядра. Поэтому большему значению главного квантового числа соответствует больший размер электронного облака. Электроны, характеризующиеся одним и тем же значением главного квантового числа n, образуют электронные облака приблизительно одинаковых размеров. Это позволяет говорить о существовании в атоме электронных слоёв (или электронных оболочек). Вместо понятия «электронный слой» часто употребляют понятие «энергетический уровень». Если несколько электронов характеризуются одним и тем же значением главного квантового числа, то в этом случае говорят, что электроны находятся на одном и том же энергетическом уровне. Если n = 1, то электроны находятся на первом энергетическом уровне (самом близком к ядру); если n = 2, то электроны находятся на втором энергетическом уровне (более удалённом от ядра) и т.д.
Орбитальное(2-ое) квантовое число Не только энергия электрона в атоме принимает определённые значения; произвольной не может быть также и форма электронного облака. Она определяется орбитальным квантовым числом l (прежде его часто называли побочным квантовым числом).
Орбитальное квантовое число l принимает целочисленные значения от 0 до (n-1). Например, если главное квантовое число n = 3, то орбитальное квантовое число l может принимать следующие значения: l = 0; 1; 2. Часто численные значения l заменяют буквенными обозначениями. Если l = 0, то говорят об s-электронных облаках, при l = 1 – о p-электронных облаках, при l = 2 – о d-электронных облаках.
Главное квантовое число (n)
|
Возможные значения орбитального квантового числа (l) |
Форма электронного облака |
Буквенное обозначение |
1 |
0 |
|
s |
2 |
0 |
|
s |
1 |
|
p |
|
3 |
0 |
|
s |
1 |
|
p |
|
2 |
|
d |
для s-электронов l = 0, ml = 0; для p-электронов l = 1, ml = -1; 0; +1; для d-электронов l = 2, ml = -2; -1; 0; +1; +2; для f-электронов l = 3, ml = -3; -2; -1; 0; +1;+2;+3.
Таблица – Форма электронных облаков
Таким образом, магнитное квантовое число ml может принимать (2l + 1) значений; столько же существует облака относительно ядра атома. Например, три p-электронных облака с ml = -1; 0; +1 располагаются в пространстве перпендикулярно друг другу.вариантов ориентации электронного
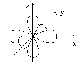
Рисунок–Расположение p-электронных облаков в пространстве
Атомные орбитали
Состояние электрона в атоме, характеризующееся тремя квантовыми числами n, l, ml , называется атомной орбиталью. Часто орбиталь также определяют как область пространства, в которой наиболее вероятно нахождение электрона.
Совокупность орбиталей с одним и тем же значением главного квантового числа n образует энергетический уровень. Орбитали некоторого энергетического уровня, характеризующиеся одним и тем же значением орбитального квантового числа l, образуют энергетический подуровень.
Очевидно, что число орбиталей на подуровне равно числу значений магнитного квантового числа ml, которые оно может принимать при данном l. Так, на любом энергетическом уровне может находиться только одна s-орбиталь; она и образует s-подуровень. Если некоторый энергетический уровень образован также орбиталями другого типа, то p-орбиталей всегда будет три; они образуют p-подуровень. d-подуровень образован пятью d-орбиталями, а семь f-орбиталей образуют f-подуровень.
Например,
показанные ниже орбитали все вместе
образуют третий энергетический уровень,
так как все они характеризуются одним
и тем же значением главного квантового
числа n = 3. Третий энергетический уровень
делится на три подуровня, несколько
различающихся по энергии: s-орбитали
имеют более низкую энергию, чем p-орбитали,
а p-орбитали, более низкую энергию, чем
d-орбитали. Каждый подуровень образован
орбиталями с одинаковым значением
орбитального квантового числа l.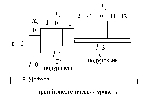
Спиновое квантовое число(4-ое) Исследование атомных спектров показало, что помимо квантовых чисел n, l, ml, электрон характеризуется ещё одной квантованной величиной, не связанной с движением электрона вокруг ядра, а определяющей его собственное движение. Эта величина получила название спинового квантового числа (ms). У электрона спиновое квантовое число может принимать два значения: ms = +1/2 и ms = -1/2 . Схематическое изображение:
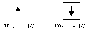
Четыре квантовых числа n, l, ml, ms однозначно определяют состояние электрона в атоме.
Принцип Паули
Согласно
принципу Паули в
атоме не может быть двух электронов, у
которых
все четыре
квантовых числа были бы одинаковы.
Из этого следует, что на
каждой атомной орбитали, характеризующейся
определёнными значениями n, l, ml
,может
находиться не более двух электронов,
причём спины этих электронов должны
быть противоположно направлены
(только в этом случае спиновые квантовые
числа электронов будут отличаться:у
одного электрона ms
= +1/2, у другого ms
= -1/2). 
Обозначение неспаренного электрона на атомной орбитали:
О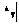 бозначение
двух спаренных электронов с противоположными
спинами, находящихся на одной атомной
орбитали:
бозначение
двух спаренных электронов с противоположными
спинами, находящихся на одной атомной
орбитали:
№3
П.З. открыт Менделеевым в 1869 году. Первон. форм-ка: св-ва элементов, а также св-ва, образуемых ими простых вещ-в и соединений нах-ся в периодической зависимости от величины атомных масс элементов.
Открытие ПЗ дало Менделееву основу для классиф. хим-их элементов и создания периодич. системы. До Менделеева нек. делали попытки для систематизации хим. элементов. Менделеев смог создать объективную основу для классиф. хим. элементов. Этой основой оказалась атомная масса хим. элементов, которая в то время дост.изучена. Он расположил известные в то время 63хим. элемента в порядке атомных масс .И обратил внимание на то, что в рядах через опред-ое кол-во хим. элементов св-ва повторяются. Расположив столбцами группы элементов Менделеев обнаружил сходство элементов друг с другом. При этом были учтены хим-ие и физ-ие св-ва, а также простых и сложных вещ-в. в результате чего, он получил таблицу, которая выражала периодичность изменения св-в элементов и их соединений.Эту таблицу он и назвал ПЕРИОДИЧЕСКАЯ ТАБЛИЦА, в которой каждый элемент занимал определённое место.
На основе ПЗ Менделеев смог указать в Пер. системе места ещё не известных тогда 12хим. элементов, а также описать их физические и химические св-ва, а также образуемых ими простых в-в и соединений.Эти предсказания подтвердились. С 1894-1898были открыты инертные газы(8гр: неон, криптон…)
Периодическая система химических элементов
В настоящее время известно 115хим. элем-ов. Последние элементы были получены в небольших количествах, и практич. значения не получили. Тем не менее периодич. система может пополняться новыми элементами.Форма графич. изображения период. системы: длинная, короткая. В длиной форме каждый период записан в 1 ряд.В короткой длинные периоды записываются в 2ряда.
Периодич. система состоит из 7 периодов, расположенных в таблице горизонтально и 18групп расп-ых в таблице вертикально.
Период-гориз-ый ряд элементов, начинающихся щел-ым Ме и заканч-щийся инертным благородным газом.1,2,3-короткие периоды; 4,5,6,7-длинные периоды.
Группа-вертикальный ряд элементов.Кажная Гр. состоит из2 подгрупп: главная-А, побочная-Б.
Смысл периодич. зависимости: св-ва простых вещ-в и соединений элементов изменяются монотонно в каждом периоде и скачкообразно на границе периода.
Периодом слева направо неМе-ие св-ва усиливаются, а Ме- ослабевают.
В периодах слева направо кисл. св-ва оксидов и их гидратов усиливаются, а основные ослабевают.
В главной подгруппе сверху вниз Ме-ие св-ва элементов усиливаются, а не Ме-ие ослабевают.
В главных подгруппах сверху вних основные св-ва гидратов и их оксидов усиливаются, а кислотные ослабевают.
№4
Хим. связь- совокупное взаимодействие между атомами, приводящие к образованию устойч. структур(молекул, ионов, кристаллов).
Теория ХС Бернана и Бертолли «бровитан теории ХС», согласно кот. взаимод. между атомами связ. гравитац-го взаимоид-ия, т.е. силами притяжения.
Теория ХС Берцелиуса согл. кот. атомы сост. из 2-х полюсов + и -, причём преобладает один из полюсов. Разнозаряженные атомы прит. друг к другу и обр. хим. связь.
Теория 1916 году немецкий учёный В. Коссель предположил, что при взаимодействии двух атомов один из них отдаёт электроны, а другой принимает; Тот, который отдаёт электроны превращ. в положит. заряж. ион, а тот который отриц. онеон. Электростатическое притяжение образовавшихся ионов приводит к образованию устойчивого соединения. Дальнейшее развитие идей Косселя привело к созданию современных представлений об ионной связи. Недостатки т.Косселя: 1) объяснялось образование ХС неск-ко для соединений сост. из атомов с разной или противопол. полярностью.
Теория не объяснила образование ХС между атомами с одинаковой или близкой электроотрицат-стью. В том же 1916 г Дж. Льюис высказал предположение, что химическая связь возникает в результате образования электронной пары, одновременно принадлежащей двум атомам. Эта идея послужила исходным пунктом для разработки современной теории ковалентной связи.Процесс спаривания электронов при образовании молекулы водорода может быть изображён следующей схемой:
Описание ХС –описание распределения электронной плотности в молекуле. Сущ. 2 способа описания ХС:
1. Метод Валентных связей (ВС)
2. Метод молекулярных орбиталей
В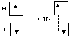 основу метода ВС положено, что любая
ковалентная химическая связь возникает
в результате взаимодействия двух
электронов с противоположно направленными
спинами, причём изначально эти электроны
принадлежат различным атомам, а
образующаяся общая электронная пара –
обоим атомам. Такой механизм образования
ковалентной связи называется обменным
механизмом.
Именно по обменному механизму образованы
химические связи в молекулах водорода
и хлороводорода:
основу метода ВС положено, что любая
ковалентная химическая связь возникает
в результате взаимодействия двух
электронов с противоположно направленными
спинами, причём изначально эти электроны
принадлежат различным атомам, а
образующаяся общая электронная пара –
обоим атомам. Такой механизм образования
ковалентной связи называется обменным
механизмом.
Именно по обменному механизму образованы
химические связи в молекулах водорода
и хлороводорода: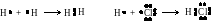
Согласно методу ВС ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Валентность-способность атомов образовывать ХС. Валентность может совпадать с числом неспаренных электронов в основном состоянии(в сост. покоя) и может не совпадать с числом неспаренных электронов. В методе молекулярных орбиталей рассматривается молекула как единое целое, а электроны, принадлежащие всей молекуле вцелом. Сост.электрона описыв. молек. орбиталями.
Хим. связь –сов-ть сил, удерживающих атомы или ионы в молекулах и кристаллах.
В зав-сти от распр. эл. плотности относительно ядер различают след. типы ХС:
1.Ковалентная, 2.Ионная, 3.Металлическая, 4.Водородная.
Наиболее распр-ый тип связи-КС.
КС образуется парой или несколькими парами электронов; обобществляемых между соседними атомами. Под общей электонной парой понимают сгусток электр. плотности, образующ. между 2 атомами в результате перекрывания эл. облаков принадлежащих им неспаренных электронов.
К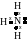 роме
обменного
механизма
возможен донорно-акцепторный
механизм
образования ковалентной связи, отличие
которого можно показать на примере
образования иона аммония. Атом азота в
молекуле аммиака связан с тремя атомами
водорода тремя ковалентными связями,
образованными по обменному механизму.
Кроме того, у атома азота есть два
спаренных электрона. Такая пара электронов
тоже может участвовать в образовании
ковалентной связи с другим атомом, если
во внешнем электронном слое этого атома
е
роме
обменного
механизма
возможен донорно-акцепторный
механизм
образования ковалентной связи, отличие
которого можно показать на примере
образования иона аммония. Атом азота в
молекуле аммиака связан с тремя атомами
водорода тремя ковалентными связями,
образованными по обменному механизму.
Кроме того, у атома азота есть два
спаренных электрона. Такая пара электронов
тоже может участвовать в образовании
ковалентной связи с другим атомом, если
во внешнем электронном слое этого атома
е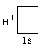 сть
свободная орбиталь. Незаполненная
орбиталь есть у иона водорода. При
взаимодействии молекулы аммиака с ионом
водорода ковалентная связь возникает
вследствие того, что неподелённая пара
электронов атома азота, перекрываясь
со свободной орбиталью иона H+,
становится общей для обоих атомов. В
результате этого взаимодействия
образуется ион аммония.
сть
свободная орбиталь. Незаполненная
орбиталь есть у иона водорода. При
взаимодействии молекулы аммиака с ионом
водорода ковалентная связь возникает
вследствие того, что неподелённая пара
электронов атома азота, перекрываясь
со свободной орбиталью иона H+,
становится общей для обоих атомов. В
результате этого взаимодействия
образуется ион аммония.
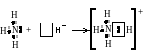 Направленность
ковалентной связи
Направленность
ковалентной связи
Образование ковалентной связи, являющееся результатом перекрывания валентных электронных облаков взаимодействующих атомов, возможно только при определённой взаимной ориентации электронных облаков. При этом область перекрывания располагается в определённом направлении по отношению к взаимодействующим атомам. Иначе говоря, ковалентная связь обладает направленностью.
Ков. связь может полярной и неполярной.
Электроотр-сть- способность атомов оттягивать на себя общую электр. пару для образ. ХС. Электр-сть харак-ет способность атомов удерж. электроны.
Ионная- связь, образ-щаяся между атомами, элек-сть которых сильно различается. Атом, отдавший электроны превращ. в положит. заряженный ион(катион), а атом принявший электроны превр. в отриц. заряж. ион.
Противопол. ковал. связи- ионная связь не обладает направл-стью и насыщенностью. Ионная связьхар-на для неорган. соединений. Отличительная черта-мгновенность протекания реакц.,дисссоциац. водных растворов, высотой t плавления и кипения, растворимость полярных растворителях и электрич. проводимость растворов и расплавов.
Металлической связь- связь между атомами в кристаллах металлов. У металлов имеется избыток валентных орбиталей и недостаток электронов. При сближен. атомов в рез. образов. кристаллич. решётки валентн. орбитали соседних атомов перекрываются. Благодаря чему электроны свободно перемещ. с одной орбитали на другую. Метал-ую связь нельзя отнести ни к ионному, ни к ковалентному типу. Возможность перемещения электронов по кристаллу определяет высокую электрич. проводимость Ме.
Водородная связь. Атом водорода способен соедин. одноврем. с 2 др. атомами. входящими в состав разных молекул или одной и той же молекулы. Причём с одним из атомов водорода обычно связан сильнее за счёт ков. связи, чем др. атомом.
Водор-ая связь образуется между активными атомами водор. и сильно электроотриц. атомами(F,N,Cl,O,S)
Активные атомы водорода связ. с другими атомами сильно полярной ков. связью. По своему хар-ру водородная связь явл-ся электростатической. Её энергия значительно ниже энергии ков. связи и равна от 4-х до 33-х к/Дж.
4)Образование ковалентной связи, являющееся результатом перекрывания валентных электронных облаков взаимодействующих атомов, возможно только при определённой взаимной ориентации электронных облаков. При этом область перекрывания располагается в определённом направлении по отношению к взаимодействующим атомам. Иначе говоря, ковалентная связь обладает направленностью.
Представление
о направленности ковалентных связей
позволяет объяснить взаимное расположение
атомов в многоатомных молекулах. Так,
например, при образовании молекулы воды
электронные облака двух неспаренных
2p-электронов
атома кислорода перекрываются с
1s-электронными
облаками двух атомов водорода. Поскольку
p-электронные
облака атома кислорода расположены
перпендикулярно друг к другу, то молекула
H2O
имеет угловое строение, причём можно
было бы предположить, 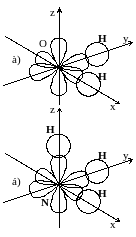 что
угол между связями O–H
должен составлять 90°.
что
угол между связями O–H
должен составлять 90°.
М
Рисунок 1.3 – Схема образования ковалентных связей: а)в молекуле воды;
б) в молекуле аммиака
олекула аммиака, образующаяся при взаимодействии трёх p-электронов атома азота с s-электронами трёх атомов водорода, имеет структуру пирамиды, в вершине которой находится атом азота, а в основании пирамиды – атомы водорода (рисунок 1.3 б). И в этом случае следовало бы ожидать, что в молекуле NH3 углы между связями N–H будут равны 90°. На самом же деле углы между связями (т.е. валентные углы) в молекулах воды и аммиака несколько отличаются от 90°. Причина этого обсуждается далее.Если область перекрывания электронных облаков находится на оси, соединяющей ядра взаимодействующих атомов (т.е. на оси связи), то такая ковалентная связь называется σ-связью (сигма-связь) (рисунок 1.4 а – в).
При взаимодействии p-электронных облаков, ориентированных перпендикулярно оси связи, образуется не одна, а две области перекрывания, расположенные по обе стороны от этой оси. Такая ковалентная связь называется π-связью (пи-связь) (рисунок 1.4 г).
Рисунок 1.4 – Образование σ- и π-связей:
а) образование σ-связи при перекрывании двух s-электронных облаков;
б) образование σ-связи при перекрывании s- и p-электронных облаков;
в) образование σ-связи при перекрывании двух p-электронных облаков;
г) образование π -связи при перекрывании двух p-электронных облаков
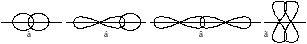
образовании молекулы азота из атомов, три неспаренных p-электрона одного атома азота и три неспаренных p-электрона другого, образуют одну σ- и две π-связи (рисунок 1.5) .
Рисунок 1.5 – Взаимодействие p-электронных облаков атомов азота при образовании молекулы N2
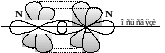
Гибридизация атомных орбиталей
Для объяснения отличия валентных углов в молекулах воды и аммиака от 90° необходимо учесть, что устойчивому состоянию молекулы отвечает такая её геометрия и такое пространственное расположение электронных облаков внешних оболочек атомов, при которых потенциальная энергия соединения будет минимальной. Это приводит к тому, что при образовании соединения формы и взаимное расположение электронных облаков атомов изменяются по сравнению с их формами и взаимным расположением в свободных атомах. В результате достигается более полное перекрывание валентных электронных облаков и, вследствие этого, образование более прочных ковалентных связей. В рамках метода валентных связей такая перестройка электронной структуры атома рассматривается на основе представления о гибридизации атомных орбиталей.
Метод гибридизации атомных орбиталей исходит из предположения, что при образовании соединения вместо исходных атомных s-, p- и d-электронных облаков образуются такие равноценные «смешанные» (т.е. гибридные) электронные облака, которые вытянуты по направлению к соседним атомам, вследствие чего достигается более полное перекрывание с электронными облаками этих атомов. Такое изменение электронных облаков требует затраты энергии, однако более полное перекрывание электронных облаков взаимодействующих атомов приводит к образованию более прочных химических связей и, как следствие, к некоторому выигрышу в энергии. Если этот энергетический выигрыш достаточен, чтобы скомпенсировать затраты энергии на деформацию исходных электронных облаков атомов, то такая гибридизация приводит к уменьшению потенциальной энергии образующейся молекулы и повышению устойчивости молекулы. Далее концепция гибридизации атомных орбиталей рассматривается на конкретных примерах образования молекул BeF2 , BF3 , CH4 , SF6 .
Атом
бериллия в возбуждённом состоянии имеет
два неспаренных электрона, занимающих
2s-
и 2p-орбитали.
При перекрывании этих орбиталей с
p-э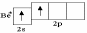 лектронными
облаками двух атомов фтора могли бы
образоваться две ковалентные связи.
Так как s-
и p-орбитали
отличаются по форме и энергии, то
образовавшиеся связи должны были бы
быть неравноценными. Опыт же показывает,
что в молекуле BeF2
обе связи равноценны. Этот факт можно
объяснить с позиций теории гибридизации
атомных орбиталей: вместо одной s-
и одной p-орбиталей
атома бериллия образуются две гибридные
sp-орбитали,
которые расположены под углом 180° друг
к другу (рисунок 1.6). Образование двух
sp-гибридных
орбиталей из одной s-
и одной p-орбиталей
называется sp-гибридизацией.
Перекрывание гибридных sp-электронных
облаков атома бериллия с p-электронными
облаками атомов фтора приводит к
образованию линейной молекулы BeF2
(рисунок 1.6).
лектронными
облаками двух атомов фтора могли бы
образоваться две ковалентные связи.
Так как s-
и p-орбитали
отличаются по форме и энергии, то
образовавшиеся связи должны были бы
быть неравноценными. Опыт же показывает,
что в молекуле BeF2
обе связи равноценны. Этот факт можно
объяснить с позиций теории гибридизации
атомных орбиталей: вместо одной s-
и одной p-орбиталей
атома бериллия образуются две гибридные
sp-орбитали,
которые расположены под углом 180° друг
к другу (рисунок 1.6). Образование двух
sp-гибридных
орбиталей из одной s-
и одной p-орбиталей
называется sp-гибридизацией.
Перекрывание гибридных sp-электронных
облаков атома бериллия с p-электронными
облаками атомов фтора приводит к
образованию линейной молекулы BeF2
(рисунок 1.6).
Рисунок 1.6 – sp-гибридизация
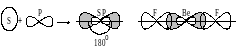
Таким образом, при sp-гибридизации электронных облаков центрального атома образующаяся молекула имеет линейную конфигурацию.
Возможны и другие случаи гибридизации атомных орбиталей, причём число образующихся гибридных орбиталей равно числу исходных атомных орбиталей, участвующих в гибридизации. Например, при гибридизации одной s- и двух p-орбиталей (sp2-гибридизация; читается: «эс-пэ-два») образуются три равноценные sp2-орбитали. В этом случае гибридные электронные облака располагаются под углом 120° друг к другу (рисунок 1.7).
Рисунок 1.7 – sp2-гибридизация
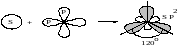
Этому
типу гибридизации соответствует
образование плоской треугольной
молекулы. Примером такой молекулы
является BF3.
И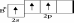 сходные
орбитали атома бора в возбуждённом
состоянии (одна s-
и две p-орбитали)
участвуют в гибридизации с образованием
трёх равноценных sp2-орбиталей.
Поэтому молекула BF3
построена в форме правильного треугольника,
в центре которого находится атом бора,
а в вершинах располагаются атомы фтора.
сходные
орбитали атома бора в возбуждённом
состоянии (одна s-
и две p-орбитали)
участвуют в гибридизации с образованием
трёх равноценных sp2-орбиталей.
Поэтому молекула BF3
построена в форме правильного треугольника,
в центре которого находится атом бора,
а в вершинах располагаются атомы фтора.
Е
Рисунок 1.8 – sp3-гибридизация
сли в гибридизации участвует одна s- и три p-орбитали (sp3-гибридизация; читается: «эс-пэ-три»), то в результате образуются четыре гибридные sp3-орбитали, вытянутые по направлению к вершинам тетраэдра, т.е. sp3-электронные облака ориентированы в пространстве под углом 109° 28´ по отношению друг к другу
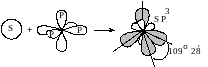
Этот
тип гибридизации осуществляется в
возбуждённом 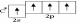 атоме
углерода при образовании молекулы CH4.
Поэтому молекула метана имеет форму
тетраэдра, причём все четыре связи С–H
в этой молекуле равноценны.
атоме
углерода при образовании молекулы CH4.
Поэтому молекула метана имеет форму
тетраэдра, причём все четыре связи С–H
в этой молекуле равноценны.
П
Рисунок 1.9 – Схема образования химических связей:
а) в молекуле воды;
б) в молекуле аммиака
ри образовании молекул воды и аммиака также происходит sp3-гибридизация электронных облаков атомов кислорода и азота соответственно. Именно поэтому валентные углы в молекулах воды и аммиака равны не 90°, а близки к тетраэдрическим (∠ HOH = = 104,5°; ∠ HNH = 107,3°). Некоторое отличие этих углов от 109°28´ объясняется следующим образом. У атома кислорода из четырёх гибридных орбиталей только две участвуют в образовании химических связей с атомами водорода, а две другие заняты неподелёнными парами электронов. В молекуле аммиака из четырёх гибридных sp3-орбиталей атома азота только три участвуют в образовании химических связей; одна гибридная sp3-орбиталь содержит неподелённую пару электронов (рисунок 1.9 б). Такая асимметрия в распределении электронных облаков вокруг ядер атомов кислорода (в молекулах воды) и азота (в молекулах аммиака) приводит к наблюдаемым отклонениям валентных углов от тетраэдрических, характерных для случая sp3-гибридизации.
У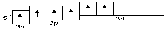 элементов третьего и последующего
периодов в образовании гибридных
электронных облаков могут участвовать
и d-орбитали.
Например, при образовании молекулы SF6
происходит гибридизация одной s-,
трёх p-
и двух d-орбиталей
возбуждённого атома серы (sp3d2-гибридизация).
элементов третьего и последующего
периодов в образовании гибридных
электронных облаков могут участвовать
и d-орбитали.
Например, при образовании молекулы SF6
происходит гибридизация одной s-,
трёх p-
и двух d-орбиталей
возбуждённого атома серы (sp3d2-гибридизация).
При sp3d2-гибридизации образуются шесть равноценных гибридных орбиталей, вытянутых к вершинам октаэдра (рисунок 1.10). Именно sp3d2-гибридизацией объясняется октаэдрическая структура молекулы SF6 .

Рисунок 1.10 – sp3d2-гибридизация
В отличие от ковалентной связи, ионная связь не обладает направленностью, поскольку взаимодействие между ионами осуществляется независимо от направления (рисунок 1.11).
Д
Рисунок 1.11 – Ненаправленность и ненасыщаемость ионной связи
 ва
разноимённых иона, притянувшиеся друг
к другу, сохраняют способность
электростатически взаимодействовать
с другими ионами. В этом состоит ещё
одно различие между ионным и ковалентным
типами связи: ионная связь не обладает
насыщаемостью (рисунок. 1.11). Поэтому к
данному иону может присоединиться
различное число ионов противоположного
знака. Это число определяется размерами
взаимодействующих ионов, а также тем,
что силы притяжения между противоположно
заряженными ионами должны преобладать
над силами отталкивания, действующими
между одноимённо заряженными ионами.
ва
разноимённых иона, притянувшиеся друг
к другу, сохраняют способность
электростатически взаимодействовать
с другими ионами. В этом состоит ещё
одно различие между ионным и ковалентным
типами связи: ионная связь не обладает
насыщаемостью (рисунок. 1.11). Поэтому к
данному иону может присоединиться
различное число ионов противоположного
знака. Это число определяется размерами
взаимодействующих ионов, а также тем,
что силы притяжения между противоположно
заряженными ионами должны преобладать
над силами отталкивания, действующими
между одноимённо заряженными ионами.
№5
Хим. вещ-во(ХВ)- любая сов-ть атомов или молекул. ХВ хар-ся составом и строением. Состав бывает количественный и качественный.
Строение в-ва- порядок связи между атомами, хар-р этих связей и взаимное расположение атомов в простр-ве.
Хим. вещ-ва бывают простые и сложные. Все вещ-ва обладают физико-химическими св-ами, агрегат сост, запахом, t плав,кип ,плотностью, n-показатель преломления.
Химич. св-во вещ-ва – способность вещ-ва вступать во взаимодействие с др. вещ-ами или претерпевать иные изменения, приводящие к образованию новых вещ-в с иным составом, строением и св-вами. Явление при котором из одних вещ-в образуются другие наз-ся химич. реакциями, они запис в виде: А+В(реагенты)=С+Д(конечные)
ХР классиф. по 5 различным признакам:
1) В зависимости от механизма реакции, реакции делятся на простые и сложные:-простые(состоят из1 этапа) –сложные(реакции, сост. из2 или неск. этапов)
К сложным реац. относятся параллельные, последовательные, сопряжённые.
паралл- если исх. вещ-во одновременно участвует в нескольких реакциях, приводящие к образованию различных продуктов;
последов- такие реакции при которых продукт начальной реакции явл. исх-ым вещ-ом для след. реакции;
сопряжённые- реакции 1 из кот. идёт самопроизвольно, другая имеет место только в присутствии первой. Идущая самопроизвольная реакц. наз первичной, индуцированная- вторичной. К сопр. реак. отн-ся цепные реакции, которые идут по свободно-радикальному механизму.
Свободный радикал- атом, имеющий неспаренный электрони обладающий выс. хим. активностью.
2) В зав. от числа исх. и конечных. в-в реакции делят:
– реакции соединения-это реакции, в которых из двух или нескольких более простых веществ получается одно более сложное вещество:
2 H2 + O2 2 H2O; C2H4 + Cl2 C2H4Cl2 .
– реакции разложения- процессы, в которых из одного более сложного вещества образуется несколько более простых веществ:
(CuOH)2CO3 2 CuO + CO2 + H2O; 2 Cu(NO3)2 2 CuO + 4 NO2 + O2 .
Частным случаем реакций разложения можно также считать реакции электролитической диссоциации: Al2(SO4)3 2 Al3+ + 3 SO42–.
– реакции замещения.В реакциях замещения простое вещество взаимодействует с химическим соединением, причём атомы некоторого элемента в химическом соединении замещаются атомами простого вещества:
CuSO4 + Zn ZnSO4 + Cu; Fe + 2 HCl FeCl2 + H2;
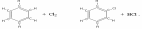
– реакции ионного обмена.При протекании реакций ионного обмена катион одного из реагирующих веществ соединяется с анионом другого вещества, в результате чего и образуются продукты реакции: Na2SO4 + BaCl2 BaSO4 + 2 HCl .
Все рассмотренные выше реакции можно, в свою очередь, разделить на две большие группы: реакции, протекающие без изменения степеней окисления элементов и окислительно-восстановительные реакции, при протекании которых наблюдается изменение степеней окисления. Следует заметить, что одни из реакций соединения и разложения являются окислительно-восстановительными, другие – нет. Реакции ионного обмена не являются окислительно-восстановительными, а реакции замещения, напротив, всегда протекают с изменением степеней окисления элементов.
При дальнейшем рассмотрении данной темы более подробно обсуждаются протекающие в водных растворах реакции ионного обмена и окислительно-восстановительные реакции.
Реакции ионного обмена Обменные реакции протекают, как правило, при смешивании растворов электролитов; электролитами называют вещества, которые в растворах (а также в расплавах) распадаются на ионы (т.е. диссоциируют). Из ранее рассмотренного материала следует, что электролитами являются кислоты, основания и соли.
Реакция ионного обмена протекает в том случае, если в качестве продукта реакции образуется хотя бы одно из следующих веществ:
– малорастворимое соединение, выпадающее в осадок;
– вещество, удаляющееся из сферы реакции в виде газа;
– слабодиссоциирующий электролит.
Важным случаем реакций ионного обмена являются реакции взаимодействия кислот и щелочей (реакции нейтрализации).
При нейтрализации многоосновной кислоты избытком щёлочи образуется средняя соль (т.е. все атомы водорода в молекуле кислоты заместятся на металл); при недостатке щёлочи образуются кислые соли:
H3PO4 + NaOH NaH2PO4 + H2O; H3PO4 + OH– H2PO4– + H2O;
H3PO4 + 2 NaOH Na2HPO4 + 2 H2O; H3PO4 + 2 OH– HPO42– + 2 H2O;
H3PO4 + 3 NaOH Na3PO4 + 3 H2O; H3PO4 + 3 OH– PO43– + 3 H2O .
При нейтрализации многокислотного основания избытком кислоты образуется средняя соль (т.е. все гидроксогруппы основания замещаются на кислотный остаток); при недостатке кислоты образуются основные соли:
Al(OH)3 + HCl Al(OH)2Cl + H2O; Al(OH)3 + H+ Al(OH)2+ + H2O;
Al(OH)3 + 2 HCl AlOHCl2 + 2 H2O; Al(OH)3 + 2 H+ AlOH2+ + 2 H2O;
Al(OH)3 + 3 HCl Al(OH)3 + 3 H2O; Al(OH)3 + 3 H+ Al3+ + 3 H2O .
Очевидно, что если на кислую соль подействовать далее избытком основания, то произойдёт дальнейшая нейтрализация с образованием средней соли и воды: NaH2PO4 + 2 NaOH Na3PO4 + 2 H2O;
H2PO4– + 2 OH– PO43– + 3 H2O;
3 NaH2PO4 + 3 Ba(OH)2 Na3PO4 + Ba3(PO4)2 + 6 H2O;
3 H2PO4– + 3 Ba2+ + 6 OH– PO43– + Ba3(PO4)2 + 6 H2O.
Аналогично, если на основную соль подействовать избытком кислоты, то произойдёт дальнейшая нейтрализация, и образуется средняя соль и вода:
Al(OH)2Cl + 2 HCl AlCl3 + 2 H2O;
3 Al(OH)2Cl + 3 H2SO4 AlCl3 + Al2(SO4)3 + 6 H2O.
Для обеих последних реакций сокращённое ионно-молекулярное уравнение одно и то же: Al(OH)2+ + 2 H+ Al3+ + 2 H2O.
Из условия протекания реакций ионного обмена следует, что слабые кислоты могут быть вытеснены из их солей сильными кислотами. Поэтому избыток любой сильной кислоты вытесняет слабую кислоту как из кислой, так и из средней соли: 2 Na3PO4 + 3 H2SO4 3 Na2SO4 + 2 H3PO4; PO43– + 3 H+ H3PO4;
2 Al(H2PO4)3 + 3 H2SO4 Al2(SO4)3 + 6 H3PO4; H2PO4– + H+ H3PO4 .
Аналогичным образом, действием избытка щелочи на соли слабых оснований (как средние, так и основные) можно получить соответствующее основание:
Fe2(SO4)3 + 6 NaOH 2 Fe(OH)3 + 3 Na2SO4; Fe3+ + 3 OH– Fe(OH)3;
FeOH(NO3)2 + 2 NaOH Fe(OH)3 + 2 NaNO3; FeOH2+ + 2 OH– Fe(OH)3.
Важно понимать, что наличие среди исходных веществ малорастворимого в воде соединения, газообразного вещества или слабого электролита не означает, что реакция невозможна. Реакция ионного обмена не будет протекать лишь в том случае, если продуктами реакции не являются или осадок, или газ, или слабый электролит. Сказанное можно подтвердить следующими примерами.
CaCO3↓ + 2 HCl CaCl2 + CO2 + H2O
CaCO3↓ + 2 H+ + 2 Cl– Ca2+ + 2 Cl– + CO2 + H2O
CaCO3↓ + 2 H+ Ca2+ + CO2 + H2O
4.3 Окислительно-восстановительные реакции
4.3.1 Общие сведения об окислительно-восстановительных реакциях
Любая окислительно-восстановительная реакция представляет собой процесс взаимодействия веществ с изменением степени окисления элементов.
Окислением называется процесс отдачи электронов. Вещество, в состав которого входит элемент, отдающий электроны и, вследствие этого, повышающий свою степень окисления, называется восстановителем.
Восстановлением называется процесс присоединения электронов. Вещество, в состав которого входит элемент, принимающий электроны и, вследствие этого, понижающий свою степень окисления, называется окислителем.
Таким образом, окислитель принимает электроны и восстанавливается, а восстановитель отдаёт электроны и окисляется. Разумеется, что в любой окислительно-восстановительной реакции число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
2 e–
-1
-1
0
0


2 KI (восстановитель) + Cl2 (окислитель) I2 + 2 KCl
Если атом некоторого элемента находится в высшей степени окисления, то он не может отдавать электроны и далее повышать степень окисления, т.е. он не может быть восстановителем. Атомы в высшей степени окисления могут быть только окислителями. Например, азотная кислота во всех окислительно-восстановительных реакциях ведёт себя как окислитель, т.к. атом азота в молекуле HNO3 находится в высшей степени окисления +5. Если атом некоторого элемента находится в низшей степени окисления, то он не может принимать электроны и далее понижать степень окисления, т.е. он не может быть окислителем. Атомы в низшей степени окисления могут быть только восстановителями. Например, иодид калия проявляет за счёт иодид иона только восстановительные свойства, т.к. атом йода имеет низшую степень окисления – минус 1. Если степень окисления элемента промежуточная, то в зависимости от условий реакции этот элемент может проявлять как свойства восстановителя, так и свойства окислителя. Некоторые вещества, содержащие в своём составе атомы в промежуточной степени окисления, могут в одной и той же реакции выступать как в роли окислителя, так и в роли восстановителя. Наиболее характерна эта реакция для неметаллов. Например, в реакции
+5
0
-1
3 Cl2 + 6 NaOH NaClO3 + 5 NaCl + 3 H2O
хлор, находясь в промежуточной степени окисления (0), сам себя окисляет и восстанавливает. Поэтому такие окислительно-восстановительные реакции носят название реакций самоокисления-самовосстановления (или диспропорционирования).
Окислительно-восстановительная активность соединения определяется не только характером степени окисления, но и устойчивостью элемента в данной степени окисления. Если атом находится в неустойчивой степени окисления, то вещество, в состав которого входит этот атом тоже будет неустойчивым; такое вещество будет легко вступать в реакции, в результате которых степень окисления элемента изменится на более устойчивую.
Составление уравнений окислительно-восстановительных реакций ионно-электронным методом (методом полуреакций)
Существуют два основных способа уравнивания окислительно-восстановительных реакций: метод электронного баланса и ионно-электронный метод (метод полуреакций). Метод электронного баланса рассматривает изменение степени окисления каждого атома, изменяющего свою валентность:
4 Fe + 3 O2 2 Fe2O3 Fe Fe3+ + 3e (× 4) O2 + 4e 2 O2– (× 3).
В принципе, этот метод, позволяет уравнять любую окислительно-восстановительную реакцию. Однако при его практическом использовании выявляются два серьёзных недостатка. Во-первых, в некоторых случаях атомам приходится приписывать необычные или даже дробные степени окисления (KO3–1/3, Na2S2+2O3, Na2S4+2,5O6, Fe3+8/3O4), что затрудняет понимание химизма процессов. Во-вторых, во многих случаях, например, при расчете величины окислительно-восстановительного потенциала в аналитической химии, необходимо знать, в виде каких реальных частиц (атомов, ионов, молекул) и с какой концентрацией присутствуют в растворе реагирующие вещества. Например, в растворе K2Cr2O7 имеются ионы Cr2O72– но не ионы Cr+6 .
Ионно-электронный метод уравнивания окислительно-восстановительных реакций учитывает те реальные частицы, которые находятся в растворе, и именно этот метод используется при изучении последующих химических дисциплин – аналитической, физической и коллоидной химии.
Для уравнивания окислительно-восстановительных реакций ионно-электронным методом следует придерживаться определённой поcледовательности действий.
1) Определить, какие элементы изменяют степень окисления.
2) Сделать запись схемы реакции в ионно-молекулярном виде (сильные электролиты при этом записываются в виде ионов, а слабые электролиты, неэлектролиты, газы и осадки – в виде молекул) и выяснить, таким образом, в составе каких реальных частиц участвуют в окислительно-восстановительной реакции атомы этих элементов; записать процесс превращения исходных веществ в конечные продукты.
3) Уравнять, если это требуется, в левой и правой частях составляемого уравнения число атомов, меняющих степень окисления.
4) Уравнять число атомов кислорода и водорода, используя водород- и кислородсодержащие частицы, имеющиеся в водном растворе – H2O, H+, OH–; для уравнивания атомов кислорода и водорода существуют определённые правила (см. ниже примеры реакций).
5) Уравнять суммы зарядов ионов в левой и правой частях уравнений процессов окисления (восстановления), добавляя в ту или иную сторону требуемое число электронов.
6) Составить ионно-молекулярное уравнение окислительно-восстановительной реакции, предварительно уравняв число отданных и принятых электронов.
7) Записать уравнение реакции в молекулярном виде.
Ниже этот порядок действий рассматривается на примерах конкретных химических реакций. Na2SO3+KMnO4+H2SO4 Na2SO4+MnSO4+K2SO4+H2O
1) Mn+7 Mn+2 (восстановление); S+4– S+6 (окисление).
2)2 Na++SO32–+K++MnO4– + 2 H+ + SO42– Na+ + SO42– +Mn2+ +SO42– +2K++SO42– +H2O
MnO4– Mn2+ SO32– SO42–
3) Число атомов Mn и S не требует уравнивания.
4) В правой части реакции восстановления MnO4– Mn2+ имеет место недостаток четырёх атомов кислорода, который можно устранить, добавив туда 4 H2O, а в левую часть 8 H+. Аналогично, в реакции окисления SO32– SO42– недостаток одного атома кислорода в левой части уравнения можно устранить, записав влево одну молекулу H2O, а вправо – два иона H+: MnO4– + 8 H+ Mn2+ + 4 H2O SO32– + H2O SO42– + 2 H+.
Если в какой-либо части составляемого ионно-электронного уравнения реакции, протекающей в кислой среде, имеется недостаток атомов кислорода, то в эту часть уравнения на каждый недостающий атом кислорода следует записать одну молекулу Н2О, а в другую – два иона Н+.
№6
Раствором называется твёрдая или жидкая гомогенная физико-химическая система, состоящая из двух или более компонентов, количества которых могут изменяться в широких пределах. Гомогенной называется система, состоящая из одной фазы (например, только жидкой, только твёрдой, или только газообразной фазы). Фаза – это часть системы, отделённая от других частей этой же системы поверхностью раздела, при переходе через которую свойства изменяются скачком. Гетерогенная система состоит из нескольких фаз, отделённых друг от друга поверхностью раздела.
Примеры гомогенных систем: любая газовая смесь, раствор сахара в воде. Примеры гетерогенных систем: вода со льдом, насыщенный раствор с осадком (жидкая фаза и твёрдая фаза), угольная пыль в атмосфере (твёрдая фаза и газовая фаза), смесь песка и мела (твёрдая фаза песка и твёрдая фаза мела), смесь подсолнечного масла и воды (жидкая фаза масла и жидкая фаза воды).
Всякий раствор состоит из растворённых веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Растворителем обычно считают тот компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор (например, в случае водного раствора соли растворителем является вода). Если оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Однородность растворов делает их сходными с химическими соединениями. Выделение теплоты при растворении некоторых веществ также указывает на химическое взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах.В свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения. Непостоянство состава растворов сближает их с механическими смесями, но от смесей они отличаются своей гомогенностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями. Наиболее важный вид растворов – жидкие растворы, которые рассматриваются далее более подробно.
Растворение кристалла твёрдого вещества в жидкости протекает следующим образом. Когда кристалл вносят в жидкость, в которой он может растворяться, от его поверхности отрываются отдельные молекулы или ионы, которые вследствие диффузии равномерно распределяются по всему объёму растворителя. Отделение молекул или ионов от твёрдого тела вызвано, с одной стороны, их собственным колебательным движением, а с другой – притяжением к молекулам растворителя. Этот процесс должен был бы продолжаться до полного растворения любого количества кристаллов, если бы одновременно не происходил обратный процесс – кристаллизация. Перешедшие в раствор молекулы или ионы, сталкиваясь с поверхностью ещё нерастворившегося вещества, снова притягиваются к нему и входят в состав его кристаллов. Выделение молекул или ионов из раствора будет происходить тем быстрее, чем больше их концентрация в растворе. Так как концентрация по мере растворения увеличивается, то наступит момент химического равновесия, когда скорость растворения равна скорости кристаллизации. Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором.
При растворении кристаллов происходит их разрушение, что требует затраты энергии, поэтому растворение должно было бы всегда протекать с поглощением теплоты. Однако, как было ранее отмечено, некоторые вещества, находящиеся в кристаллическом состоянии, растворяются в жидкостях с выделением теплоты. Это позволяет предположить, что одновременно с разрушением кристаллов твёрдого тела при его растворении происходит какое-то химическое взаимодействие между растворителем и растворяемым веществом, и в результате этого взаимодействия энергии выделяется больше, чем её расходуется на разрушение кристаллической решётки.
В настоящее время установлено, что при растворении многих веществ, их молекулы или ионы связываются с молекулами растворителя, образуя соединения, называемые сольватами. Процесс взаимодействия растворяющегося вещества с растворителем называется сольватацией. В частном случае, когда растворителем является вода, эти соединения называются гидратами, а процесс их образования – гидратацией.
Пример образования гидратированного катиона показан на рис. 6.1. При растворении веществ с ионной структурой полярные молекулы воды, являющиеся диполями, удерживаются около ионов силами электростатического притяжения (ион-дипольное взаимодействие).
Предположение о существовании в водных растворах гидратов было высказано и обосновано в восьмидесятых годах XIX века Д.И. Менделеевым, который считал, что растворение – не только физический, но и химический процесс.
Гидраты, как правило, – это неустойчивые соединения, во многих случаях разлагающиеся при выпаривании растворов. Но иногда гидраты настолько прочны, что выделяющиеся из раствора кристаллы растворённого вещества содержат определённое количество молекул воды. Этот факт также является подтверждением химизма процессов растворения. Такие вещества, в состав кристаллов которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода – кристаллизационной. Примеры кристаллогидратов: CuSO4·5H2O, Na2SO4·10H2O, FeSO4·7H2O, Na2CO3·10H2O.
Прочность связи между веществом и кристаллизационной водой в кристаллогидратах различна. Некоторые из них (например, Na2CO3·10H2O) теряют кристаллизационную воду («выветриваются») уже при комнатной температуре. Для обезвоживания других кристаллогидратов (CuSO4·5H2O) требуется более сильное нагревание.
Под концентрацией раствора понимают содержание растворённого вещества в определённом объёме или массе раствора или растворителя. Растворы с большой концентрацией растворённого вещества называются концентрированными, с малой – разбавленными.
Существует много различных способов выражения концентрации растворов. Один из наиболее употребительных в химии и технике способов – это выражение концентрации растворённого вещества в виде массовой доли (процентной концентрации).
Массовая доля (процентная концентрация) показывает, сколько массовых частей растворённого вещества содержится в 100 массовых частях раствора. Если в качестве единицы массы выбрать грамм, то определение массовой доли можно также записать следующим образом: массовая доля (процентная концентрация) показывает, сколько граммов растворённого вещества содержится в 100 граммах раствора.
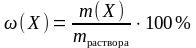
(6.1 а)
В формуле 6.1 а ω(X) – массовая доля растворённого вещества X; m(X) – масса растворённого вещества X; mраствора – масса раствора.