
- •24. Металлическая связь
- •[Природа
- •[История
- •]Свойства
- •]В воде [Механизм Гротгуса
- •]В нуклеиновых кислотах и белках
- •]В полимерах
- •25. Гибридизация
- •Особенности молекул, содержащих σ-связи
- •28. Механизм образования связи
- •Валентность атомов. Перекрывание атомных орбиталей
- •Гибридизация атомных орбиталей. Геометрическая форма частиц
- •Гибридизация атомных орбиталей. Геометрическая форма частиц
- •Геометрическая форма молекул и реакционная способность веществ
- •]Определение
- •]Связь с термодинамической устойчивостью системы
- •]Применение в химии []Связь с химическим потенциалом
- •]Историческая справка
- •30. Энергетические эффекты химических реакций
- •31. Превращение энергии при химических реакциях
- •]Определение
- •]Связь с термодинамической устойчивостью системы
- •]Применение в химии ]Связь с химическим потенциалом
- •Направленность химических процессов
- •[Определение
- •]Связь с термодинамической устойчивостью системы
- •]Применение в химии ]Связь с химическим потенциалом
- •]Энергия Гиббса и направление протекания реакции
- •]Историческая справка
- •35. []Скорость химической реакции
- •]Порядок химической реакции
- •]Реакция нулевого порядка
- •[]Реакция первого порядка
- •]Реакция второго порядка
- •]Молекулярность реакции
- •]Катализ
- •]Катализ в биохимии
- •]Равновесие
- •Способы выражения константы равновесия
- •]Стандартная константа равновесия
- •]Константа равновесия реакций в гетерогенных системах
- •]Константа равновесия и изменение энергии Гиббса
- •39. Гомогенные и гетерогенные реакции
- •Закон действующих масс
- •]Закон действующих масс в химической кинетике
- •]Закон действующих масс в химической термодинамике
- •]Методы расчета константы равновесия
- •[Править]Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции
Если начальное и конечное состояния химической реакции (реакций) совпадают, то ее (их) тепловой эффект равен нулю.
30. Энергетические эффекты химических реакций
Молекулы состоят из атомов. Возможны два вида молекул: содержащие одинаковые атомы и молекулы, содержащие два или более различных атомов. Эти два вида молекул имеют разные названия: - элемент — состоит из атомов только одного вида; - соединение, или сложное вещество, — состоит из двух или более различных атомов. Один моль каждого индивидуального вещества обладает определенным теплосодержанием, равно, как и определенной массой. Теплосодержание является мерой энергии, накапливаемой веществом при его образовании. Тепловой эффект химической реакции равен разности между теплосодержанием ее продуктов реакции и теплосодержанием реагирующих веществ. Если теплосодержание реагирующих веществ больше, чем у продуктов реакции, то при такой химической реакции тепло выделяется и она называется экзотермической. Если же теплосодержание продуктов реакции больше, чем у реагирующих веществ, то при реакции тепло поглощается и такая реакция называется эндотермической. То, что в каждом индивидуальном веществе заключено определенное количество энергии, служит объяснением тепловых эффектов химических реакций. Теплосодержание иногда называют химической энергией, так как его величина тесно связана с химическим составом вещества. Каждый атом обладает энергией, часть которой связана с электронами и часть — с ядром. Электроны в атоме обладают кинетической энергией, и поскольку они притягиваются ядром и отталкиваются друг от друга, то и потенциальной энергией. Алгебраическая сумма кинетической и потенциальной энергий и составляют энергию, необходимую для отрыва электрона от атомного ядра. Ядро же каждого атома — колоссальный источник энергии, которая связана с взаимодействием ядерных частиц — нуклонов. Так как атомные ядра при химических реакциях не испытывают изменений, энергия ядер не изменяется. Поэтому энергия ядер не входит в теплосодержание молекул. При нагревании твердого вещества увеличивается кинетическая энергия колебательного движения молекул около мест, занимаемых ими в кристаллической решетке. С повышением температуры эти тепловые колебания все больше нарушают упорядоченное строение кристалла. Когда же такое хаотическое тепловое движение молекул становится слишком быстрым, кристаллическая решетка полностью разрушается. При температуре, выше которой кинетическая энергия частиц обусловливает столь быстрое хаотическое движение, что кристаллическая решетка больше не может оставаться устойчивой, происходит фазовый переход — плавление твердого вещества. В жидкости каждая молекула обладает значительно большей свободой движения, особенно поступательного и вращательного. При нагревании жидкости молекулярное движение усиливается. Кинетическая энергия обуславливает хаотическое движение, приводящее к распределению молекул по возможно большему объему. Поэтому с ростом температуры по мере увеличения энергии движения все большее число молекул может удаляться из жидкой фазы туда, где потенциальная энергия минимальна. При этом происходит другой фазовый переход — испарение жидкости. Если продолжать нагревать вещество, то наступит момент, когда кинетическая энергия колебательного, вращательного и поступательного движений по величине станет сравнима с энергией химических связей. Тогда молекулы начинают разрушаться. По этой причине на Солнце не обнаружены молекулы, содержащие более чем два атома: только самые простые, двухатомные молекулы. Температура на Солнце настолько высока (6000 К), что более сложные молекулы не могут существовать. Если дальше продолжать нагревание, то в конце концов достигается температура, при которой кинетическая энергия настолько возрастает, что разрушаются ядра. Тогда начинаются ядерные реакции. Предполагается, что на некоторых звездах существуют условия, благоприятные для быстрых ядерных реакций. Затраты энергии при химических реакциях в 10—100 раз больше, чем при фазовых переходах.
В ходе химической реакции происходит превращение веществ, следовательно, разрушаются химические связи, на что затрачивается энергия и образуются другие вещества при этом энергия выделяется. Поэтому любая реакция сопровождается поглощением или выделением энергии.
Внутренняя энергия (U) – это общий запас энергии системы, включая энергию поступательного и вращательного движения молекул, энергии внутремолекульных колебаний атомов, внитреядерную энергии, т. е. все виды энергии, кроме кинетической энергии как целого и ее потенциальной энергии. Внутренняя энергия является функцией состояния системы, т. е. U=f(P,V,T,νа,νв,νс)
Сумма внутренней энергии и произведение объема системы на внешнее давление называется энтальпия H, Дж – это теплосодержание системы. Энтальпия как и внутренняя энергия является функцией состояния системы.
Для того чтобы сравнить между собой теплоты различных реакций необходимо точно указать условия при которых они протекают. В термохимии принято стандартное состояние вещества при – это давление 101 кПа и температура 298 к.
Символ ∆H0298 – это изменение энтальпии веществ реакции в стандартном состоянии для исходных веществ и продуктов реакции.
Стандартная теплота образования вещества ∆H0f298 – это тепловой эффект образования одного моль вещества из простых веществ при стандартных условиях. Условно принято, что теплота образования простых веществ равна 0. Величина стандартных тепло образования сложных веществ приводится в справочных таблицах.
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данноехимическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозыв организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
Закон открыт русским химиком Г. И. Гессом в 1840 г.; он является частным случаем первого начала термодинамикиприменительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
]Следствия из закона Гесса
Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрическиекоэффициенты (ν):
Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т. н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры.
Если начальное и конечное состояния химической реакции (реакций) совпадают, то ее (их) тепловой эффект равен нулю.
Рассчет теплового эффекта
)По термохимическому уравнению С(тв)+ О2(г)=СО2(г)+393,5 кДж расчитайте сколько выделится теплоты при сгорании 1 кг угля? 2)При взаимодействии 1,8 г алюминия с кислородом выделяется 55,65 кДж теплоты.Составьте термохимическое уравнение этой реакции. Решение: 1)n(С)=83,33моль 1моль с-393,5 кДж 83,33 моль-х; х=32791,67кДж,а у ответах 32,792кДж.Ошибка с переводом единиц? 2)n(Al)=0,067моль 0,067моль Al-55,65 кДж 4 моль-х; х=3322,388кДж, а в ответах 3339кДж.Выходит через массу считали?А нужно только через количество?
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия - это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Если термомеханическую систему рассматривать как состоящую из макротела (газа) и поршня с грузом весом Р = p S, уравновешивающего давление газа р внутри сосуда, то такая система называется расширенной.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот =pSx = pV
![]()
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии. Энтальпия системы H — аналогично внутренней энергии и другим термодинамическим потенциалам — имеет вполне определенное значение для каждого состояния, т. е. является функцией состояния. Следовательно, в процессе изменения состояния
![]()
Изменение
энтальпии (или Тепловой
эффект химической реакции)
не зависит от пути процесса, определяясь
только начальным и конечным состоянием
системы. Если система каким-либо путём
возвращается в исходное состояние
(круговой процесс), то изменение любого
её параметра, являющегося функцией
состояния, равно нулю, отсюда ![]() ,
или же
,
или же
![]()
Дифференциал энтальпии, выраженный в собственных переменных — через энтропию S и давление p:
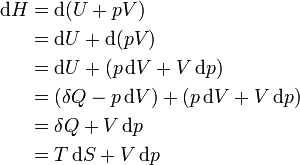
Поскольку
в квазиравновесных
процессах ![]() —
количество теплоты, подведенной к
системе, отсюда вытекает физический
смысл введения понятия энтальпии: ее
изменение — это тепло, подведенное
к системе в изобарическом
процессе (при
постоянном давлении). Практическое
применение этой функции основано на
том, что множество химических процессов
в реальных или лабораторных условиях
реализуются именно при постоянном
(атмосферном) давлении, когда резервуар
открыт. Так,энтальпия
образования —
количество энергии, которое выделяется
или поглощается при образовании сложного
вещества из простых веществ.
—
количество теплоты, подведенной к
системе, отсюда вытекает физический
смысл введения понятия энтальпии: ее
изменение — это тепло, подведенное
к системе в изобарическом
процессе (при
постоянном давлении). Практическое
применение этой функции основано на
том, что множество химических процессов
в реальных или лабораторных условиях
реализуются именно при постоянном
(атмосферном) давлении, когда резервуар
открыт. Так,энтальпия
образования —
количество энергии, которое выделяется
или поглощается при образовании сложного
вещества из простых веществ.
Все химические реакции сопровождаются выделением (экзотермические) или поглощением (эндотермические) тепла. Мерой теплоты реакции служит изменение энтальпии ΔН, которая соответствует теплообмену при постоянном давлении. В случае экзотермических реакций система теряет тепло и ΔН — величина отрицательная. В случае эндотермических реакций система поглощает тепло и ΔН — величина положительная.
Энтальпией системы удобно пользоваться в тех случаях, когда в качестве независимых переменных, определяющих состояние системы, выбирают давление р и температуруТ
![]()
В
этом случае изменение энтальпии в
изобарическом процессе практически
удобно рассчитывать, зная теплоемкость
при постоянном давлении ![]() (термохимический
закон Кирхгофа):
(термохимический
закон Кирхгофа): 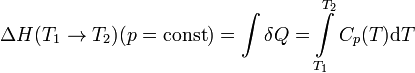
При этом используется эмпирическое разложение теплоёмкости в ряд по степеням Т:
![]()
Энтальпия — величина
аддитивная (экстенсивная),
т. е. для сложной системы равна сумме
энтальпий её независимых частей ![]() .
Подобно другим термодинамическим
потенциалам, энтальпия определяется с
точностью до постоянного слагаемого,
которому в термодинамике часто придают
произвольные значения (например, при
расчете и построении тепловых диаграмм).
При наличии немеханических сил величина
энтальпии системы равна
.
Подобно другим термодинамическим
потенциалам, энтальпия определяется с
точностью до постоянного слагаемого,
которому в термодинамике часто придают
произвольные значения (например, при
расчете и построении тепловых диаграмм).
При наличии немеханических сил величина
энтальпии системы равна
![]()
где ![]() —
обобщённая сила;
—
обобщённая сила; ![]() — обобщённая
координата.
— обобщённая
координата.
]Примеры
-
Неорганические соединения (при 25 °C) стандартная энтальпия реакции
Хим соединение
Фаза (вещества)
Химическая формула
Δ Hf0 кДж/моль
Аммиак
сольватированный
NH3 (NH4OH)
−80.8
Аммиак
газообразный
NH3
−46.1
Карбонат натрия
твёрдый
Na2CO3
−1131
Хлорид натрия (соль)
сольватированный
NaCl
−407
Хлорид натрия (соль)
твёрдый
NaCl
−411.12
Хлорид натрия (соль)
жидкий
NaCl
−385.92
Хлорид натрия (соль)
газообразный
NaCl
−181.42
Гидроксид натрия
сольватированный
NaOH
−469.6
Гидроксид натрия
твёрдый
NaOH
−426.7
Нитрат натрия
сольватированный
NaNO3
−446.2
Нитрат натрия
твёрдый
NaNO3
−424.8
Диоксид серы
газообразный
SO2
−297
Серная кислота
жидкий
H2SO4
−814
Диоксид кремния
твёрдый
SiO2
−911
Диоксид азота
газообразый
NO2
+33
Монооксид азота
газообразный
NO
+90
Вода
жидкий
H2O
−286
Вода
газообразный
H2O
−241.8
Диоксид углерода
газообразный
CO2
−393.5
Водород
газообразный
H2
0
Фтор
газообразный
F2
0
Хлор
газообразный
Cl2
0
Бром
жидкий
Br2
0
Бром
газоообразный
Br2
0
