
- •24. Металлическая связь
- •[Природа
- •[История
- •]Свойства
- •]В воде [Механизм Гротгуса
- •]В нуклеиновых кислотах и белках
- •]В полимерах
- •25. Гибридизация
- •Особенности молекул, содержащих σ-связи
- •28. Механизм образования связи
- •Валентность атомов. Перекрывание атомных орбиталей
- •Гибридизация атомных орбиталей. Геометрическая форма частиц
- •Гибридизация атомных орбиталей. Геометрическая форма частиц
- •Геометрическая форма молекул и реакционная способность веществ
- •]Определение
- •]Связь с термодинамической устойчивостью системы
- •]Применение в химии []Связь с химическим потенциалом
- •]Историческая справка
- •30. Энергетические эффекты химических реакций
- •31. Превращение энергии при химических реакциях
- •]Определение
- •]Связь с термодинамической устойчивостью системы
- •]Применение в химии ]Связь с химическим потенциалом
- •Направленность химических процессов
- •[Определение
- •]Связь с термодинамической устойчивостью системы
- •]Применение в химии ]Связь с химическим потенциалом
- •]Энергия Гиббса и направление протекания реакции
- •]Историческая справка
- •35. []Скорость химической реакции
- •]Порядок химической реакции
- •]Реакция нулевого порядка
- •[]Реакция первого порядка
- •]Реакция второго порядка
- •]Молекулярность реакции
- •]Катализ
- •]Катализ в биохимии
- •]Равновесие
- •Способы выражения константы равновесия
- •]Стандартная константа равновесия
- •]Константа равновесия реакций в гетерогенных системах
- •]Константа равновесия и изменение энергии Гиббса
- •39. Гомогенные и гетерогенные реакции
- •Закон действующих масс
- •]Закон действующих масс в химической кинетике
- •]Закон действующих масс в химической термодинамике
- •]Методы расчета константы равновесия
- •[Править]Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции
Способы выражения константы равновесия
Для реакции в смеси идеальных газов константа равновесия может быть выражена через равновесные парциальные давления компонентов pi по формуле[1]:
![]()
где νi — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным). Kp не зависит от общего давления, от исходных количеств веществ или от того, какие участники реакции были взяты в качестве исходных, но зависит от температуры [2].
Например, для реакции окисления монооксида углерода:
2CO + O2 = 2CO2
константа равновесия может быть рассчитана по уравнению:
![]()
Если реакция протекает в идеальном растворе и концентрация компонентов выражена через молярность ci, константа равновесия принимает вид:
![]()
Для реакций в смеси реальных газов или в реальном растворе вместо парциального давления и концентрации используют соответственно фугитивность fi и активность ai:
![]()
![]()
В
некоторых случаях (в зависимости от
способа выражения) константа равновесия
может являться функцией не только
температуры, но и давления. Так, для
реакции в смеси идеальных газов
парциальное давление компонента может
быть выражено по закону
Дальтона через
суммарное давление и мольную долю
компонента (![]() ),
тогда легко показать[2],
что:
),
тогда легко показать[2],
что:
![]()
где Δn —
изменение числа молей веществ в ходе
реакции. Видно, что Kx зависит
от давления. Если число молей продуктов
реакции равно числу молей исходных
веществ (![]() ),
то
),
то ![]() .
.
]Стандартная константа равновесия
Стандартная
константа равновесия реакции в смеси
идеальных газов (когда начальные
парциальные давления участников реакции
равны их значениям в стандартном
состоянии ![]() =
0,1013 МПа или 1 атм) может быть рассчитана
по выражению:
=
0,1013 МПа или 1 атм) может быть рассчитана
по выражению:
![]()
где ![]() —
относительные парциальные давления
компонентов,
—
относительные парциальные давления
компонентов, ![]() .
.
Стандартная константа равновесия — безразмерная величина. Она связана с Kp соотношением:
![]()
Видно,
что если
выражены
в атмосферах, то ![]() и
и ![]() .
.
Для
реакции в смеси реальных газов в
стандартном начальном состоянии
парциальные фугитивности газов
принимаются равными их парциальным
давлениям ![]() =
0,1013 МПа или 1 атм. Kf связана
с K0 соотношением:
=
0,1013 МПа или 1 атм. Kf связана
с K0 соотношением:
![]()
где γi — коэффициент фугитивности i-го реального газа в смеси.
]Константа равновесия реакций в гетерогенных системах
Для гетерогенной химической реакции, например, между компонентами реального газа и реального раствора, константа равновесия в общем случае может быть выражена уравнением:
![]()
где fi — фугитивность компонентов газовой фазы, а ak — активность компонентов конденсированной фазы.
Если конденсированные фазы (твёрдые или жидкие) представляют собой практически чистые вещества, их активности постоянны и могут быть включены в константу равновесия (то есть в левую часть выражения выше). Условно можно принять их равными единице и, таким образом, исключить из выражения.
Например, для реакции твёрдофазного восстановления оксида железа:
FeOт + COг = Feт + CO2г
константа равновесия (при условии, что газовая фаза идеальна) имеет вид:
![]()
]Константа равновесия и изменение энергии Гиббса
Для реакции, протекающей в изобарно-изотермических условиях, в некотором неравновесном исходном состоянии энергии Гиббса или химические потенциалы реагирующих веществ и продуктов реакции в общем случае не одинаковы, их разность (ΔGT) может быть рассчитана по уравнению:
![]()
где ![]() —
отношение парциальных давлений участников
реакции в исходном состоянии в степенях,
равных их стехиометрическим коэффициентам;
R —универсальная
газовая постоянная.
—
отношение парциальных давлений участников
реакции в исходном состоянии в степенях,
равных их стехиометрическим коэффициентам;
R —универсальная
газовая постоянная.
Это уравнение называют уравнением изотермы химической реакции. Оно позволяет рассчитать изменение энергии Гиббса при протекании процесса и определить направление протекания реакции:
при ![]() —
реакция идёт в прямом направлении, слева
направо;
—
реакция идёт в прямом направлении, слева
направо;
при ![]() —
реакция достигла равновесного состояния;
—
реакция достигла равновесного состояния;
при ![]() —
реакция идёт в обратном направлении.
—
реакция идёт в обратном направлении.
37.
Ско́рость (часто
обозначается ![]() ,
от англ. velocity или фр. vitesse) — векторная физическая величина,
характеризующая быстроту перемещения и
направления движения материальной
точки в
пространстве относительно выбранной системы
отсчёта (например, угловая
скорость).
Этим же словом может называться скалярная величина,
точнее модуль производной радиус-вектора.
,
от англ. velocity или фр. vitesse) — векторная физическая величина,
характеризующая быстроту перемещения и
направления движения материальной
точки в
пространстве относительно выбранной системы
отсчёта (например, угловая
скорость).
Этим же словом может называться скалярная величина,
точнее модуль производной радиус-вектора.
В науке используется также скорость в широком смысле, как быстрота изменения какой-либо величины (не обязательно радиус-вектора) в зависимости от другой (чаще изменения во времени, но также в пространстве или любой другой). Так, например, говорят о скорости изменения температуры, скорости химической реакции, групповой скорости, скорости соединения, угловой скорости и т. д. Математически характеризуетсяпроизводной функции.
Скорость — характеристика движения точки, при равномерном движении численно равная отношению пройденного пути s к промежутку времени t, за который этот путь пройден.
Следует различать координатную и физическую скорости. При введении криволинейных или обобщённых координат положение тел описывается их зависимостью от времени. Производные от координат тела по времени при этом называются координатными скоростями.
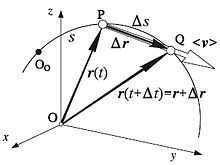
Иллюстрация средней и мгновенной скорости.
Следует отличать понятие средней скорости перемещения от понятия средней скорости пути, равной отношению пройденного точкой пути ко времени, за которое этот путь был пройден. В отличие от скорости перемещения, средняя скорость пути — скаляр.
Когда говорят о средней скорости, для различения, скорость согласно выше приведённому определению называют мгновенной скоростью.
Так, хотя мгновенная скорость бегуна, кружащего по стадиону, в каждый момент времени отлична от нуля, его средняя скорость (перемещения) от старта до финиша оказывается равной нулю, если точки старта и финиша совпадают. Заметим, что при этом, средняя путевая скорость остаётся отличной от нуля.
Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени. Различают среднюю скорость
![]() (3.1.)
(3.1.)
где Δс=с2-с1 – изменение концентрации вещества за промежуток времени Δt=t2-t1. Знак (+) означает, что вещество образуется, а знак ( - ) – что вещество расходуется в ходе реакции.
Истинная (мгновенная) скорость реакции определяется соотношением
|
![]() (3.2)
(3.2)
где dc – бесконечно малое изменение концентрации вещества за бесконечно малый промежуток времени dt.
Основными факторами, определяющими скорость реакции, являются концентрация, температура и катализатор. Скорость реакций с участием газообразных реагентов зависит также от давления.
Зависимость скорости реакции от концентрации. Все химические реакции можно разделить на гомогенные игетерогенные. К гомогенным реакциям относятся реакции, протекающие между веществами, находящимися в одном агрегатном состоянии, если между ними отсутствуют поверхности раздела. К гомогенным реакциям относятся реакции между газами, неограниченно смешивающимися жидкостями и жидкими растворами. Гомогенные реакции протекают в объеме, т.е. имеются наиболее благоприятные условия для контакта молекул реагирующих веществ.
Реакции между веществами, находящимися в разных агрегатных состояниях, или в одном агрегатном состоянии, но разделенных поверхностями раздела относятся к гетерогенным реакциям. К ним относятся, например, реакции между газом и жидкостью, двумя несмешивающимися жидкостями, механическими смесями твердых веществ. В гетерогенных реакциях химический процесс протекает только на поверхностях раздела реагирующих фаз.
Зависимость скорости гомогенной реакции от концентрации определяется законом действующих масс (закон Гульдберга и Вааге, 1864-1867): Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
38. Зависимость скорости реакции от температуры. Для большинства реакций справедливо правило Вант-Гоффа: Повышение температуры на 10К увеличивает скорость большинства реакций в 2-4 раза:
![]() (3.9)
(3.9)
где![]() -
скорости реакции при Т1 и
Т2;
γ – термический коэффициент скорости
химической реакции
-
скорости реакции при Т1 и
Т2;
γ – термический коэффициент скорости
химической реакции ![]()
Молекулы газов и жидкостей испытывают ежесекундно огромное число столкновений. Только очень малая доля столкновений заканчивается химическими превращениями. Такие столкновения называются эффективными соударениями. Молекулы - активными молекулами с большей энергией. Избыточная энергия необходима молекулам для преодоления сил отталкивания внешних электронных оболочек и для образования активированного комплекса, т.е. промежуточного соединения между исходными веществами и конечными продуктами. В активированном комплексе старые связи еще не полностью разрушены, а новые еще не полностью образовались.
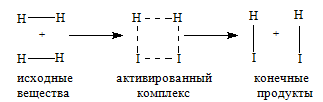
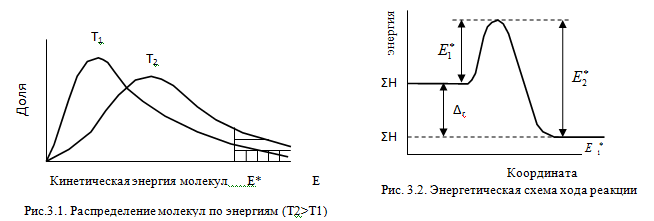
Изменение
энергии в ходе химической
реакции показано схемой процесса
активации (рис.3.2). По оси ординат отложена
потенциальная энергия системы. Абсцисса
- координата реакции или реакционного
пути. В процессе химического превращения
переход системы из начального состояния
с энергией ΣНi в конечное состояние с
ΣНf происходит через энергетический
барьер ![]() .
.
Энергия
активации (Е*) -
это энергия, необходимая для перевода
в состояние активированного комплекса
1 моль реагирующих веществ. Разность
ΣНf - ΣНi составляет тепловой эффект
реакции (ΔrH). Для обратной реакции
тепловой эффект будет иметь ту же
величину, но противоположный знак. Для
обратной реакции энергия активации
составит величину. ![]()
Зависимость
константы скорости химической реакции
от температуры описывается уравнением
Аррениуса: ![]() (3.10)
(3.10)
где k – константа скорости реакции; ko – константа, зависящая от природы реагирующих веществ; Е* - энергия активации; R – универсальная газовая постоянная; Т – температура , К. Константа скорости, а следовательно и скорость химической реакции экспоненциально растет с увеличением температуры.
Изучение зависимости скорости реакции от давления показало, что при увеличении давления в 2 раза скорость реакции возрастает в 2 раза. Изучение зависимости скорости реакции от давления показало, что при увеличении давления в 1 5 раза скорость реакции возрастает в 1 5 раза, при увеличении давления в 2 5 раза скорость возрастает в то же число раз.
