
- •Физический смысл
- •6. Структура периодической системы д.И.Менделеева. Какие характеристики элемента можно определить по его положению в периодической системе. Классы элементов: s, p, d, f- элементы.
- •7. Атомный радиус. Изменение атомных радиусов в периодах и группах. Объясните характер изменений атомных радиусов в периодах и группах.
- •11.Характеристика ковалентной связи: энергия связи, длина связи, валентный угол. Их взаимосвязанность.
- •13. Свойства и хар-ка ковалентной связи: гибридизация.
- •16. Ионная связь.
- •17. Металлическая связь.
- •Механизм металлической связи
- •Дисперсионное взаимодействие
- •Индукционные взаимодействия
- •2.2. Термохимические уравнения
- •Энергия Гиббса
- •25. Концентрация растворов: нормальная концентрация. Расчет молярной массы одного эквивалента для различных классов соединений.
- •25. Концентрация растворов: нормальная концентрация. Расчет молярной массы одного эквивалента для различных классов соединений.
- •26.Концентрация раствора: молярная концентрация.
- •27. Концентрация растворов: моляльная концентрация. Определите, сколько грамм кон и воды требуется взять, чтобы приготовить 20 мл 0,5m раствора.
- •29. Слабые электролиты. Диссоциация слабых электролитов , равновесие в растворах слабых электролитов. Константа диссоциации.
- •30.Диссоциация воды. Константа диссоциации воды. Ионное произведение воды. Водородный показатель pH. Определение среды раствора.
- •32) Реакция ионного обмена — одна из видов химической реакции, характеризующаяся выделением в продукты реакции воды, газа или осадка.
- •33) Гидролиз солей.
- •Химические свойства
25. Концентрация растворов: нормальная концентрация. Расчет молярной массы одного эквивалента для различных классов соединений.
Нормальная концентрация (молярная концентрация эквивалента) (Сн) – показывает число эквивалентов растворенного вещества, содержащегося в одном литре раствора.
Сн= mx * 1000/Mэ*V
mx – масса растворенного вещества; m=V*p; m=mx+m(растворителя)
V- объем (мл)
Мэ – молярная масса эквивалента (эквивалентная масса) г/моль
Основание: Мэ=Мосн/N(OH)
Кислота: Мэ=М(кислоты)/N(H+)
Соль: Мэ = М(соли)/N(Mex+)*B(Me)
1н –однонормальный раствор (Сн=1моль/л)
0,5 – пятидецинормальный раствор
0,02 – двусантинормальный раствора
25. Концентрация растворов: нормальная концентрация. Расчет молярной массы одного эквивалента для различных классов соединений.
Нормальная концентрация (молярная концентрация эквивалента) (Сн) – показывает число эквивалентов растворенного вещества, содержащегося в одном литре раствора.
Сн= mx * 1000/Mэ*V
mx – масса растворенного вещества; m=V*p; m=mx+m(растворителя)
V- объем (мл)
Мэ – молярная масса эквивалента (эквивалентная масса) г/моль
Основание: Мэ=Мосн/N(OH)
Кислота: Мэ=М(кислоты)/N(H+)
Соль: Мэ = М(соли)/N(Mex+)*B(Me)
1н –однонормальный раствор (Сн=1моль/л)
0,5 – пятидецинормальный раствор
0,02 – двусантинормальный раствора
26.Концентрация раствора: молярная концентрация.
Молярная концентрация (См) – показывает число моль растворенного вещества, содержащегося в одном литре раствора.
См=mx * 1000/M*V
mx – масса растворенного вещества
M – молярная масса вещества (г/моль)
V- объем (мл)
1м(См=1моль/л) – молярный раствор
0,1 м(См=0,1 моль/л) - децимолярный раствор
0,01м(См=0,01 моль/л) – сантимолярный раствор
27. Концентрация растворов: моляльная концентрация. Определите, сколько грамм кон и воды требуется взять, чтобы приготовить 20 мл 0,5m раствора.
Моляльная концентрация (Сm) – показывает число моль растворенного вещества, приходящегося на один кг растворителя.
Сm=mx*1000/М*m(растворителя) моль/кг
mx – масса растворенного вещества
M – молярная масса вещества (г/моль)
28.Растворы электролитов. Сильные и слабые электролиты (определение). Степень диссоциации электролитов. Теория электролитической диссоциации. Определение кислот и оснований. Приведите примеры реакций диссоциации.
Электролиты - это вещества, растворы и расплавы, которые проводят электрический ток.
Слабые электролиты существуют в растворах преимущественно в виде молекул, лишь незначительная часть молекул распадается на ионы. Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия , называемой константой диссоциации.
Степень диссоциации слабого электролита обратно пропорциональна концентрации и прямо пропорциональна разбавлению раствора.
α=
Сильные электролиты в растворах существуют в виде ионов.
Степень диссоциации: α>30% – сильные, α<3% - слабые, 3%< α<30% - средние.
Стабильность
ионов в растворе достигается за счет
гидратации молекулами растворителя.
Например: NaCl-> +
+
К сильным электролитам относятся HClO4, HCl, HBr, HJ, HNO3, H2SO4 – кислоты; щелочи – NaOH, KOH, CsOH; соли с ионной кристаллической решеткой – NaCl, KBr, Li2SO4/
Основные положения теории электролитической диссоциации Аррениуса:
Электролиты в растворах распадаются на ионы, диссоциируют положительно заряженные ионы, катионы, отрицательно заряженные анионы.
Диссоциация - это процесс обратимый.
Силы взаимодействия ионов с молекулами растворителя и с друг другом малы, то есть растворы являются идеальными.
Диссоциация электролитов в растворе происходит под действием полимерных молекул растворителя
Для оценки полноты диссоциации вводится понятие степени диссоциации(α), которая ровна отношению числа молекул распавшихся на ионы (n) к общему числу молекул электролита в растворе (N).
α=n/N(max=1); α=(n/N) *100% (max = 100%)
В зависимости от степени диссоциации электролиты делят:
α>30% - сильные электролиты; практически все растворимые соли, щелочи (NaOH, KaOH), некоторые минеральные кислоты (H2SO4, HNO3, HCl, HClO4, HBr, HJ)
α<3% - слабые электролиты; вода (H2O), NH4OH, не растворимые и малорастворимые соли и основания, органические кислоты(HCOOH, CH3COOH), некоторые минеральные кислоты (H2CO3, HCN, H2S,HNO2, HCNS)
3%<=α<=30% - электролиты средней силы; H2SO3, H3PO4, некоторые органические кислоты.
Величина степени диссоциации зависит от природы растворителя, растворенного вещества, концентрации раствора и температуры.
1)Кислота – электролит при диссоциации которого в качестве катиона, образуются катионы водорода Н+
HCl
 +
+
Диссоциация много основных кислот идет ступенчато в том случае если кислота является слабым электролитом, то диссоциация по второй и по следующим ступеням не значительна.
H2SO3
+
HSO3
+
2)Основание – это электролиты при диссоциации которых в качечтве анионов образуются гидрооксид – ионы (ОН-)
а.
NaOH
+
Основание многозарядных катионов диссоциирует ступенчато и как правило по первой ступени
б.
1) Al(OH)3
 +
+
2)
 +
+
3)
 +
+
Реакции нейтрализации: NaOH + HCl = NaCl + H2O (молекулярное)
Н+ + ОН− = Н2О. (сокращенное ионное)
Ba(NO3)2 +H2SO4->BaSO4(осад) +2HNO3
 +
+ ->BaSO4(ос)
->BaSO4(ос)
NH4+NaOH->NH4OH+NaCl
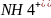 +
->NH4OH
+
->NH4OH
