
- •Курс: охрана окружающей среды в теплотехнологии: выбросы теплотехнических установок
- •Модуль 1
- •Оглавление
- •Дидактический план
- •Литература Государственные стандарты Российской Федерации
- •Основная
- •Дополнительная
- •1. Выбросы теплотехнологических установок промышленных предприятий и их влияние на окружающую среду
- •1.1. Атмосфера – основа жизни
- •1.2. Последствия загрязнения атмосферы
- •1.3. Загрязнители атмосферы
- •1.4. Выбросы в атмосферу и их характеристика
- •1.5. Нормативы качества атмосферного воздуха
- •1.6. Перемещение загрязняющих веществ в атмосфере
- •1.7. Превращение загрязняющих веществ в атмосфере
- •1.8. Основы образования загрязнителей атмосферы
- •1.9. Источники техногенного загрязнения биосферы
- •1.10. Система государственных стандартов в области охраны биосферы
- •1.11. Нормирование загрязняющих веществ в биосфере
- •1.12. Экологический паспорт предприятия
- •2. Техника и технология удаления взвешенных веществ из атмосферных выбросов
- •2.1. Физические принципы, используемые для удаления твердых и жидких загрязнений
- •1 Источник высокого напряжения; 2 плоский электрод; 3 провод; 4 чехол короны; 5 электроны; 6 положительные ионы; 7 отрицательные ионы
- •1 Отрицательные ионы; 2 частицы, взвешенные в газе; 3 заряженная частица
- •2.2. Основные процессы извлечения газообразных примесей
- •2.3. Основные характеристики пылеуловителей
- •2.4. «Сухие» механические пылеуловители
- •2.5. «Сухие» пористые фильтры
- •1 Бункер; 2 корпус; 3 диффузор-сопло; 4 крышка; 5 труба раздающая; 6 секция клапанов; 7 коллектор сжатого воздуха; 8 секция рукавов
- •1 Корпус; 2 фильтрующие ячейки; 3 система импульсной регенерации; 4 фильтрующие элементы; 5 бункер
- •1 Корпус; 2 слой активированного угля; 3 центральная труба для подачи
- •2.6. Электрофильтры («сухие» и «мокрые»)
- •2.7. Аппараты «мокрого» пыле- и газоулавливания
- •1 Корпус; 2, 4 перегородки; 3 водоотбойник; 5 каплеуловитель; 6 вентиляционный агрегат; 7 устройство для регулирования уровня воды
- •2.8. Комбинированные методы и аппаратура очистки газов
- •6 Регулятор подачи воды; 7 разгрузочное устройство
- •2.9. Подготовка выбросов перед очисткой в пылеулавливающих устройствах
- •3. Техника и технология удаления газообразных вредных веществ из примесей
- •3.1 Абсорбционная очистка газов
- •3.2. Адсорбционная очистка газов
- •3.3. Каталитическая очистка газов
- •1 Цилиндрическая часть корпуса; 2 зернистый катализатор; 3 верхняя часть корпуса; 4 циклон; 5 шнековое устройство; 6 газораспределительная решетка
- •1 Цилиндрический корпус; 2 циклон; 3 сопло; 4 бункер, 5 эжекторное устройство
- •3.4. Термическое обезвреживание газов
- •1 Горелка; 2 топка, 3 взрывной клапан; 4 поворотный клапан; 5 сотовые перегородки; 6 дымовая труба; 7 газоход; 8 камера смешения; 9 окно; 10 перегородка
- •Задания для самостоятельной работы
- •1. Перечислить источники техногенного загрязнения биосферы:
- •2. Перечислить основные механизмы осаждения, имеющие наибольшее применение:
- •3. Перечислить основные требования к абсорбентам:
- •4. Перечислите основные требования к конструкциям каталитических реакторов:
- •5. Перечислите основные требования к оборудованию термического обезвреживания газов:
- •Глоссарий
- •Охрана окружающей среды в теплотехнологии: выбросы теплотехнических установок модуль 1
2.2. Основные процессы извлечения газообразных примесей
Абсорбция
Абсорбционная очистка основана на способности жидкостей растворять газы или химически взаимодействовать с ними. При абсорбции происходит переход вещества из газовой фазы в жидкую, при десорбции, наоборот, из жидкой в газовую фазу. Вещество, которое содержится в газовой фазе и при абсорбции переходит в жидкую фазу, называют абсорбционным компонентом, или абсорбтивом. Вещество, которое содержится в газовой фазе и при абсорбции не переходит в жидкую фазу, называют газом-носителем. Вещество, в котором происходит растворение абсорбируемых компонентов, называют абсорбентом. В отличие от абсорбируемых компонентов остальную часть газового потока обычно называют инертным газом.
Абсорбция объемное поглощение газов или паров жидкостью (абсорбентом) с образованием раствора. В промышленности осуществляют в абсорберах (устар. скрубберах), имеющих развитую поверхность соприкосновения абсорбента с поглощаемым веществом. Различают физическую и химическую. При физической абсорбции энергия взаимодействия молекул газа и абсорбента в растворе не превышает 20 кДж/моль. При химической абсорбции (хемосорбция) молекулы растворенного газа реагируют с активным центром абсорбента (энергия взаимодействия более 25 кДж/моль) или в растворе происходит диссоциация молекул газа.
Различают физическую и химическую абсорбцию (хемосорбцию).
При физической абсорбции происходит физическое растворение абсорбируемого компонента в растворителе, которое не сопровождается химической реакцией. Абсорбция происходит в том случае, если парциальное давление абсорбируемого компонента в газовой фазе больше равновесного парциального давления над данным раствором. Для многократного использования поглотитель подвергают регенерации, при этом извлекают из него абсорбированный компонент.
При химической абсорбции абсорбируемый компонент вступает в химическую реакцию с поглотителем, образуя новые химические соединения в жидкой фазе. Здесь возможны два варианта протекание обратимой и необратимой реакций. Хемосорбционные процессы обеспечивают более полное извлечение компонентов из газовых смесей. Регенерацию поглотительных растворов, получаемых при протекание обратимых хемосорбционных процессов, проводят теми же методами, что и при физической абсорбции. Регенерацию поглотительных растворов, получаемых в необратимых хемосорбционных процессах, осуществляют химическими методами.
Количество газов, которое может раствориться в жидкости, зависит от свойств газов и жидкости, а также от условий растворения: температуры жидкости и парциального давления газа над жидкостью.
При абсорбции происходит передача массы абсорбируемого компонента (массопередача) от газа к жидкости.
Массопередача массообмен через поверхность раздела или проницаемую стенку между двумя веществами или фазами.
Адсорбция
Адсорбция поглощение газов, паров или жидкостей поверхностным слоем твердого тела (адсорбента) или жидкости. Адсорбенты обычно имеют большую удельную поверхность до нескольких сотен м2/г. Физическая адсорбция результат действия дисперсионных или электростатических сил. Если адсорбция сопровождается химической реакцией поглощаемого вещества с адсорбентом, то она называется хемосорбцией. В промышленности адсорбцию осуществляют в специальных аппаратах адсорберах; применяют для осушки газов, очистки органических жидкостей и воды, улавливания ценных или вредных отходов производства.
Поглощаемое из газовой фазы вещество в процессе адсорбции называется адсорбтивом, а твердое вещество, на поверхности которого или в порах которого происходит адсорбция поглощаемого вещества, называется адсорбентом. Газовая фаза, в которой находится извлекаемый компонент, называется газом-носителем, а после того как извлеченный компонент перешел в адсорбированное состояние, его называют адсорбатом.
Явление адсорбции обусловлено наличием сил притяжения между молекулами адсорбента и адсорбтива на границе раздела соприкасающихся фаз. Процесс перехода молекул адсорбтива из газа-носителя на поверхностный слой адсорбента происходит в том случае, если силы притяжения адсорбента превосходят силы притяжения, действующие на адсорбтив со стороны газа-носителя.
Рассмотрим схему кристаллической решетки твердого тела (рис. 10).
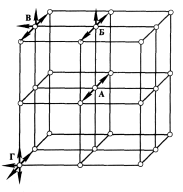
Рис. 10. Схема кристаллической решетки адсорбента
Атом «А», находящийся внутри кристалла, имеет шесть ближайших соседей, все его связи задействованы, и он не обладает свободной энергией. У атома «Б», находящегося на поверхности кристалла, только пять ближайших соседей, он имеет одну условную свободную связь и поэтому обладает большей энергией и находится в более высоком энергетическом состоянии, чем атом внутри кристалла. Еще большей энергией обладает атом «В», находящийся на грани кристалла. У него четыре ближайших соседа и, следовательно, большой избыток энергии. Самым большим избытком энергии обладает атом «Г», лежащий на вершине кристалла. У него всего три ближайших соседа (и три условно свободные связи). Этот избыток энергии называется поверхностной, и он является причиной адсорбции.
Молекулы адсорбированного вещества, переходя на поверхность адсорбента, уменьшают его энергию, в результате чего происходит выделение теплоты. Теплота физической адсорбции сравнительно невелика и составляет до 60 кДж/моль.
Силы притяжения адсорбента могут иметь различную природу физическую или химическую. В соответствии с этим различают физическую и химическую адсорбцию.
При физической адсорбции взаимодействие молекул с поверхностью адсорбента определяется сравнительно слабыми дисперсными, индукционными и ориентационными силами. При этом адсорбированные молекулы не вступают с молекулами адсорбента в химическое взаимодействие и сохраняют свою индивидуальность. Для физической адсорбции характерна высокая скорость, малая прочность связи между поверхностью адсорбента и адсорбтивом и малая теплота адсорбции. С повышением температуры количество физически адсорбированного вещества уменьшается, а увеличение давления приводит к возрастанию величины адсорбции.
Преимуществом физической адсорбции является легкая обратимость процесса. При уменьшении давления адсорбента в газовой смеси либо при увеличении температуры адсорбируемые молекулы легко десорбируются без изменения химического состава, а регенерированный адсорбент может использоваться многократно.
Высокая скорость физической адсорбции и способность адсорбентов к регенерации позволяют вести процесс циклично в условиях обратимости, т. е. с чередованием стадий поглощения и выделения извлекаемых компонентов.
В основе химической адсорбции лежит химическое взаимодействие между адсорбентом и адсорбируемым веществом. Действующие при этом силы значительно больше, чем при физической адсорбции, а высвобождающееся при этом тепло совпадает с теплом химической реакции. Как правило, оно колеблется от 20 до 400 кДж/моль. Из-за такой большой теплоты адсорбции энергия связи хемосорбируемых молекул сильно отличается от энергии связи этих же молекул в потоке газа. Соответственно и энергия, необходимая для того, чтобы хемосорбированная молекула прореагировала с молекулой другого сорта, может быть существенно меньше, чем энергия, необходимая для реакции этих же молекул в газовой фазе. Этим объясняется тот факт, что адсорбированная на поверхности твердого тела молекула легче вступает в химическую реакцию с другими молекулами. Существует и другое важное отличие химической адсорбции: молекулы адсорбтива, вступив в химическое взаимодействие, прочно удерживаются на поверхности и в порах адсорбента. Характерной особенностью химической адсорбции является и то, что скорость ее при низких температурах мала и возрастает с ростом температуры.
Адсорбция газов происходит в несколько стадий. Первой стадией является перенос молекул газа к внешней поверхности твердого вещества, и эта стадия аналогична диффузии молекул газа через стационарный слой к границе раздела фаз газ жидкость при адсорбции. Вторая стадия адсорбции заключается в том, что молекулы газа проникают в поры твердого вещества, третьей стадией является собственно адсорбция молекулы в определенной области поры. Собственно адсорбция в порах протекает очень быстро по сравнению с двумя первыми стадиями.
Наибольшее значение для очистки газов имеет физическая адсорбция.
Катализ
Катализ (от греч. katalysis разрушение), ускорение химической реакции в присутствии веществ катализаторов, которые взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав продуктов. При гомогенном катализе исходные реагенты и катализатор находятся в одной фазе (газовой или жидкой), при гетерогенном — газообразные или жидкие реагенты взаимодействуют на поверхности твердого катализатора. Катализ обусловливает высокие скорости реакций при небольших температурах; предпочтительно образование определенного продукта из ряда возможных.
Каталитическая очистка газов основана на гетерогенном катализе и служит для превращения примесей в безвредные соединения. Процесс протекает на поверхности твердых тел катализаторов. В настоящее время вопрос о том, какие реакции и в присутствии каких веществ могут возбуждаться, остается решенным неполностью и поэтому подбор катализаторов и проведение катализа в основном решается эмпирическим путем.
Для того чтобы произошла химическая реакция между атомами, молекулами и ионами, необходимо их непосредственное взаимодействие. При температуре 500 °С в 1 см3 реакционной смеси происходит 1028 столкновений частиц в секунду. Но не каждое столкновение приводит к химической реакции. Химическая реакция происходит лишь в том случае, когда система обладает необходимым запасом внутренней энергии (активации), если частицы сближаются на расстояние, при котором происходит перекрытие их электронных облаков, а следовательно, и перераспределение электронных плотностей. Только в этом случае может произойти разрушение старых и образование новых химических связей.
Энергия активации является основным фактором, определяющим скорость реакции. Чем больше энергия активации, тем меньше частиц обладают в системе такой энергией и тем медленнее протекает реакция. В то же время величина энергии активации значительно меньше энергии, требуемой для разрыва старых связей; она часто компенсируется энергией, освобождаемой при образовании новых. Задача преодоления энергетических барьеров решается путем использования катализаторов, которые снижают энергию активации и тем самым увеличивают скорость химической реакции. Таким образом, роль катализаторов с энергетической точки зрения сводится к понижению энергетического барьера, который должна преодолеть система при переходе из начального состояния в конечное.
Катализ на твердых телах складывается из следующих стадий:
внешняя диффузия реагирующих веществ к поверхности катализатора;
внутренняя диффузия в порах зерна катализатора;
химическая адсорбция одного или нескольких реагирующих компонентов на поверхности катализатора;
перегруппировка атомов (химическая реакция);
обратная диффузия продукта в порах зерна катализатора;
диффузия продуктов от поверхности зерна.
Каждая из стадий каталитического процесса должна обладать энергией активации значительно меньшей, чем энергия активации в отсутствии катализатора, иначе каталитический процесс окажется энергетически невозможен. Общая скорость каталитического процесса определяется относительными скоростями отдельных стадий и может лимитироваться наиболее медленной из них. Различают три основные области протекания каталитических процессов: кинетическую, внешнедиффузионную и внутридиффузионную. В зависимости от стадии, лимитирующей общую скорость процесса, используются различные уравнения кинетики процесса. Говоря о лимитирующей стадии процесса, предполагают, что остальные стадии протекают настолько быстро, что в каждой из них практически достигается равновесие, и свободная энергия Гиббса равна нулю.
В кинетической области суммарная скорость лимитируется скоростью химической реакции и не зависит от процессов переноса, а зависит лишь от природы реагирующих веществ. В кинетической области протекают реакции при использовании малоактивных катализаторов и при температурах, близких к температуре зажигания катализаторов. Скорость таких процессов невозможно увеличить улучшением структурных свойств катализатора (увеличением микро- и макропор). Ее можно увеличить лишь изменяя природу катализаторов, а также повышая температуру процесса. В то же время катализатор должен иметь развитую структуру микро- и макро-пор, обеспечивающую подвод реагирующих веществ в зону реакции.
Во внешнедиффузионной области суммарная скорость каталитического процесса лимитируется скоростью подвода реагирующих веществ в зону реакции. При этом предполагается, что химическая реакция протекает мгновенно. Каталитические процессы, протекающие во внешнедиффузионной области, можно ускорить, увеличивая макропоры наружной поверхности катализатора и перемешивая реагенты. Увеличивать поверхность микропор нецелесообразно, так как они практически не участвуют в процессе катализа. Пределом увеличения турбулизации потоков служит переход системы из внешнедиффузионной во внутридиффузионную или кинетическую области.
Во внутридиффузионной области суммарная скорость каталитического процесса лимитируется скоростью подвода реагирующих веществ в зону реакции в микропорах зерна катализатора. Увеличить скорость таких процессов можно путем уменьшения размеров зерна катализатора или увеличением внутренней поверхности катализатора, создаваемой тонкими порами малой длины. Большинство процессов тормозится внутренней диффузией, поэтому синтезируемые катализаторы должны обладать микропористой структурой.
Большое влияние на процесс катализа оказывает температура. Она может изменять не только скорость процесса, но и лимитирующую стадию процесса. При относительно низких температурах, где скорость реакции мала по сравнению со скоростью диффузии, концентрации реагирующих веществ и продуктов реакции по глубине зерна уменьшаются незначительно и близки к концентрации их в газовом потоке. Процесс катализа протекает в кинетической области.
С ростом температуры скорость химической реакции увеличивается, увеличивается и скорость диффузии.
Для реакций, протекающих в кинетической области, катализатор должен обладать высокой активностью и иметь развитую внутреннюю поверхность макро- и микропор, которые обеспечивали бы подвод необходимого количества реагентов в зону реакции. Для реакций, протекающих в области внешней диффузии, мелкие поры катализатора почти не играют никакой роли, но зато возрастает значение крупных пор и внешней поверхности. В этом случае целесообразно использовать крупнопористые катализаторы с развитой внешней поверхностью. В реакциях, протекающих в области внутренней диффузии, главную роль играют мелкие поры. Для таких реакций необходимо использовать катализаторы с развитой внутренней поверхностью.
Важнейшей характеристикой катализаторов является температура зажигания минимальная температура, при которой катализатор начинает проявлять свои свойства.
Температура зажигания катализатора температура, которая обычно необходима для начала каталитической реакции, зависит от присутствующих в газе веществ и типа катализатора.
В принципе, катализаторы в ходе катализа не претерпевают никаких изменений (в некоторых процессах катализаторы работают более 20 лет). Однако постепенно активность катализаторов теряется. Причиной этого могут быть физические и химические факторы.
К физическим факторам относятся истирание, перегрев, спекание и т. д.
Химические факторы являются значительно более сложной проблемой, возникающей в процессе каталитической очистки газов. К ним относится постепенное насыщение поверхности катализатора различными примесями, называемыми каталитическими ядами. В результате уменьшаются активные центры на поверхности катализатора и постепенно теряется активность катализатора. Одни и те же вещества могут являться каталитическими ядами для одних катализаторов и совершенно не причинять вреда другим. Если эти вещества можно удалить с поверхности катализатора, то его активность восстанавливается. В соответствии с этим различают обратимую и необратимую отравляемость катализаторов. При обратимой отравляемости их активность полностью восстанавливается после удаления каталитических ядов. При необратимой отравляемости катализатор не восстанавливает их свойств даже после удаления ядов из зоны реакции. Основными каталитическими ядами являются соединения серы, свинца, фосфора и др.
Термическое окисление
Термическим называется окисление компонентов выбросов при высокой (800 1000 °С) температуре. Оно применяется как в отношении газов (паров), так и горючих компонентов дисперсной фазы аэрозолей (смол, масел, летучих растворителей и др.). Основными факторами термического окисления являются температура, интенсивность перемешивания (турбулентность газовых потоков) и время пребывания газов в реакционной зоне. Решающее значение в организации процесса имеет подготовка газов к реакции, т. е. нагрев смеси до необходимой температуры и обеспечение смешения горючих газов с окислителями. Если обезвреживаемый газ содержит в своем составе достаточное для окисления токсичных примесей количество кислорода, либо этот кислород добавляется к обезвреживаемому газу заблаговременно, то процесс смешивания газов упрощается.
