
- •1 Вопрос. Параметры идеального газа.
- •2 Вопрос. Законы идеального газа.
- •3 Вопрос. Уравнение Клапейрона-Менделеева.
- •4 Вопрос. Изо-процессы с точки зрения уравнение Клапейрона-Менделеева.
- •5 Вопрос. Закон Максвелла о распределения молекул газа по скоростям и энергиям теплового движения.
- •6 Вопрос. Барометрическая формула. Распределение Больцмана.
- •7 Вопрос. Внутреннее трение вязкости.
- •8 Вопрос. Число степеней свободы. Внутренняя энергия.
- •9 Вопрос. Первое начало термодинамики.
- •10 Вопрос. Работа газа.
- •11 Вопрос. Теплоемкость.
- •12 Вопрос. Изобарный процесс.
- •13 Вопрос. Изохорный процесс.
- •14 Вопрос. Изотермический процесс.
- •15 Вопрос. Адиабатный процесс.
- •16 Вопрос. Круговой процесс (цикл).
- •17 Вопрос. Энтропия.
- •18 Вопрос. Второе начало термодинамики.
- •19 Вопрос. Цикл Карно.
- •Вопрос 20. Силы и потенциальная энергия межмолекулярного взаимодействия.
- •Вопрос 21. Уравнение Ван-дер-Ваальса.
- •Вопрос 22.Изотерма Ван-дер-Ваальса.
- •Вопрос 23. Внутренняя энергия реального газа.
- •Вопрос 24. Свойство жидкости.
- •Вопрос 25. Смачивание.
- •Вопрос 26. Давление от искривлённой поверхностью жидкости.
- •27 Вопрос. Капиллярное явлений.
- •28 Вопрос. Твердые тела.
- •Вопрос 29. Теплоемкость твердых тел.
- •Вопрос 30. Испарение, сублимация, плавление и кристаллизация.
- •Вопрос 31. Фазовые переходы 1 и 2 рода.
- •Вопрос 32. Диаграмма состояния. Тройная точка.
Вопрос 21. Уравнение Ван-дер-Ваальса.
ВДВ вывел уравнение состояния реального газа, исп. ур-е Клапейрона-Менделеева и введя в него 2 поправки а и b.
Поправка b определяется наличием сил отталкивания, кот. противодействуют проникновению в занятый молекулой объём других молекул. Всё это сводится к тому, что фактически свободный объем, в котором будут двигаться молекулы реального газа, будет не Vm, а Vm-b, где b — объем, занимаемый самими молекулами. Объём b=x4 собственному объёму молекул. Действие Fп приводит к появл. дополнит. давлению, назыв. внутр. давлением (P’). P’=a/Vm2.
Вводя эти поправки получаем уравнение ВДВ для одного моля в-ва. (Р+a/Vm2)(Vm-b)=RT
Для
произвольного кол-ва в-ва с учётом того,
что V=
![]() Vm,
ур-е ВДВ примет вид:
Vm,
ур-е ВДВ примет вид:
(P+ 2a/V2)(V/ -b)=RT
Вопрос 22.Изотерма Ван-дер-Ваальса.
Рассмотрим изотермы Ван-дер-Ваальса.
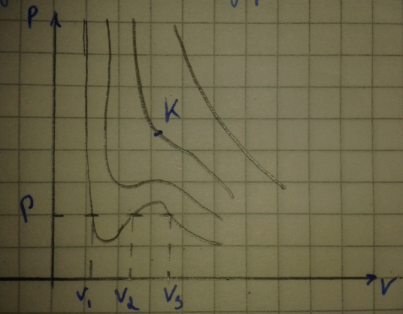
При
некоторой температуре
 на изотерме имеется одна точка перегиба
точка К эта изотерма называется
критической также критическими называются
все параметры связанные с этой точкой
на изотерме имеется одна точка перегиба
точка К эта изотерма называется
критической также критическими называются
все параметры связанные с этой точкой
 .
При низких температурах изотермы имеют
волнообразный участок.
.
При низких температурах изотермы имеют
волнообразный участок.
У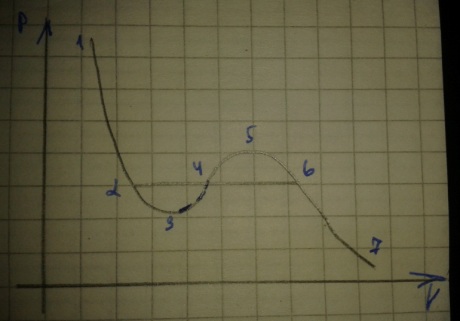 частки
1-3 и 5-7 при уменьшении объема давление
возрастает. На участке 3-5 сжатие вещества
приводит к уменьшению давления такие
состояния в природе не существуют.
Наличие участка 3-5 означает что вещество
не может оставаться в виде однородной
среды и в некоторый момент должно
наступить скачка образное изменение
состояния и распад вещества на две фазы.
Таким образом истинная изотерма имеет
вид 7-6,2-1 часть 6-7 это газообразное
состояние часть 2-1 жидкое. На участке
2-6 наблюдается равновесие жидкой и
газообразной фаз вещества. Вещество в
газообразном состоянии при температуре
ниже критической называется паром, а
пар находящийся в равновесии со своей
жидкостью называется насыщенной.
Критические параметры можно определить
подставляя их в уравнение Ван-дер-Ваальса.
частки
1-3 и 5-7 при уменьшении объема давление
возрастает. На участке 3-5 сжатие вещества
приводит к уменьшению давления такие
состояния в природе не существуют.
Наличие участка 3-5 означает что вещество
не может оставаться в виде однородной
среды и в некоторый момент должно
наступить скачка образное изменение
состояния и распад вещества на две фазы.
Таким образом истинная изотерма имеет
вид 7-6,2-1 часть 6-7 это газообразное
состояние часть 2-1 жидкое. На участке
2-6 наблюдается равновесие жидкой и
газообразной фаз вещества. Вещество в
газообразном состоянии при температуре
ниже критической называется паром, а
пар находящийся в равновесии со своей
жидкостью называется насыщенной.
Критические параметры можно определить
подставляя их в уравнение Ван-дер-Ваальса.

Если через крайние точки горизонтального участка провести линию то получится колоколообразная кривая.

Пар отличается от других газообразных состояний тем что при изотермическом сжатии происходит процесс сжижения. Газ при температуре выше критической никогда не станет жидкостью ни при каких давлениях. Участок 2-3 изображает перегретую жидкость. Участок 5-6 перенасыщенный пар.
Вопрос 23. Внутренняя энергия реального газа.
Складывается
из кинетической энергии теплового
движения его молекул и потенциальной
энергии межмолекулярного взаимодействия.
Потенциальная энергия реального газа
обусловленная сил притяжения наличие
которых приводит к возникновению
внутреннего давления.
 Работа которая затрачивается на
преодоление сил притяжения идет на
увеличение потенциальной энергии
Работа которая затрачивается на
преодоление сил притяжения идет на
увеличение потенциальной энергии
 .
Откуда
.
Откуда
 знак минус означает что молекулярные
силы создающие внутреннее давлении
являются силами притяжения. Учитывая
оба слагаемых получим что внутренняя
энергия реального газа
знак минус означает что молекулярные
силы создающие внутреннее давлении
являются силами притяжения. Учитывая
оба слагаемых получим что внутренняя
энергия реального газа
 .
Внутренняя энергия растет с повышением
температуры и с повышением объема. Если
газ расширяется без теплообмена
(адиабатный процесс) и не совершает
внешней работы то есть Q=0
и A=0 то на основании первого
начала термодинамик
.
Внутренняя энергия растет с повышением
температуры и с повышением объема. Если
газ расширяется без теплообмена
(адиабатный процесс) и не совершает
внешней работы то есть Q=0
и A=0 то на основании первого
начала термодинамик
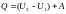 .
Следовательно при адиабатном расширении
без внешней работы внутренняя энергия
газа не изменяется. Разница справедлива
как для реального газа так и для идеального
газа но физический смысл будет различным
для идеального газа равенство внутренних
энергий свидетельствует о равенстве
температур а при адиабатном расширении
идеального газ вакуум его температура
не меняется
.
Следовательно при адиабатном расширении
без внешней работы внутренняя энергия
газа не изменяется. Разница справедлива
как для реального газа так и для идеального
газа но физический смысл будет различным
для идеального газа равенство внутренних
энергий свидетельствует о равенстве
температур а при адиабатном расширении
идеального газ вакуум его температура
не меняется

Получаем V2>V1 получаем что реальный газ при расширении охлаждается то есть Т1>Т2 или при адиабатном сжатии реальный газ нагревается.
