- •1 Вопрос. Параметры идеального газа.
- •2 Вопрос. Законы идеального газа.
- •3 Вопрос. Уравнение Клапейрона-Менделеева.
- •4 Вопрос. Изо-процессы с точки зрения уравнение Клапейрона-Менделеева.
- •5 Вопрос. Закон Максвелла о распределения молекул газа по скоростям и энергиям теплового движения.
- •6 Вопрос. Барометрическая формула. Распределение Больцмана.
- •7 Вопрос. Внутреннее трение вязкости.
- •8 Вопрос. Число степеней свободы. Внутренняя энергия.
- •9 Вопрос. Первое начало термодинамики.
- •10 Вопрос. Работа газа.
- •11 Вопрос. Теплоемкость.
- •12 Вопрос. Изобарный процесс.
- •13 Вопрос. Изохорный процесс.
- •14 Вопрос. Изотермический процесс.
- •15 Вопрос. Адиабатный процесс.
- •16 Вопрос. Круговой процесс (цикл).
- •17 Вопрос. Энтропия.
- •18 Вопрос. Второе начало термодинамики.
- •19 Вопрос. Цикл Карно.
- •Вопрос 20. Силы и потенциальная энергия межмолекулярного взаимодействия.
- •Вопрос 21. Уравнение Ван-дер-Ваальса.
- •Вопрос 22.Изотерма Ван-дер-Ваальса.
- •Вопрос 23. Внутренняя энергия реального газа.
- •Вопрос 24. Свойство жидкости.
- •Вопрос 25. Смачивание.
- •Вопрос 26. Давление от искривлённой поверхностью жидкости.
- •27 Вопрос. Капиллярное явлений.
- •28 Вопрос. Твердые тела.
- •Вопрос 29. Теплоемкость твердых тел.
- •Вопрос 30. Испарение, сублимация, плавление и кристаллизация.
- •Вопрос 31. Фазовые переходы 1 и 2 рода.
- •Вопрос 32. Диаграмма состояния. Тройная точка.
1 Вопрос. Параметры идеального газа.
Идеальный газ - идеализированная модель, в которой считают, что:
- собственный объем молекул пренебрежительно мал по сравнению с объемом сосуда.
- между молекулами газа отсутствуют силы взаимодействия.
- столкновение молекул газа между собой и стенками сосуда абсолютно упругие.
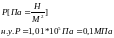
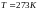
Термодинамическая температура.
T - Измеряется в кельвинах.
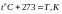
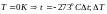
V-объём [м3]
Например
 .
.
 =m/M[моль]
=m/M[моль]
M[кг/моль]
Водород
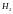
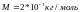
Гелий
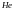

Азот
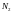
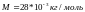
Воздух
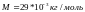
Кислород
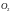
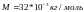
Аргон
Ar
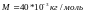

Удельный объем это объем единицы массы; это величина обратная плотности.

Термодинамическая система это совокупность макроскопических тел которые взаимодействуют и обмениваются энергией как между собой так и с окружающими телами. Состояние системы задается термодинамическими параметрами.
2 Вопрос. Законы идеального газа.
-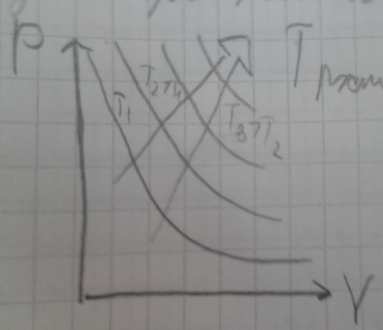 Закон Бойля-Мариотта: Для данной массы
газа при постоянной температуре
произведение давления газа на его объем
есть величина постоянная.
Закон Бойля-Мариотта: Для данной массы
газа при постоянной температуре
произведение давления газа на его объем
есть величина постоянная.
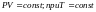 и
и
Этому закону подчиняется изотермический процесс, то есть процесс, протекающий при постоянной температуре.
Чем дальше график от системы координат, тем выше на нем температура.
Кривая, изображающая зависимость между величинами P и V, называется изотермой.
- Законы Гей-Люссака:
а) Объем данной массы газа при постоянном давлении изменяется линейно с температурой.
 и
Данному закону подчиняется изобарный,
т. е. процесс, протекающий при постоянном
давлении.
и
Данному закону подчиняется изобарный,
т. е. процесс, протекающий при постоянном
давлении.
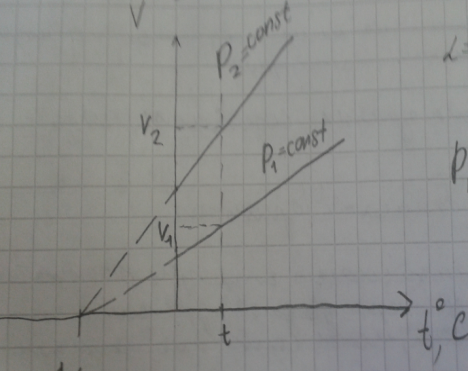
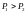
б) Давление данной массы газа при постоянном объёме растет линейно с температурой.
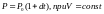 и
.
Данному закону подчиняется изохорный
процесс, то есть процесс, протекающий
при постоянном объёме.
и
.
Данному закону подчиняется изохорный
процесс, то есть процесс, протекающий
при постоянном объёме.
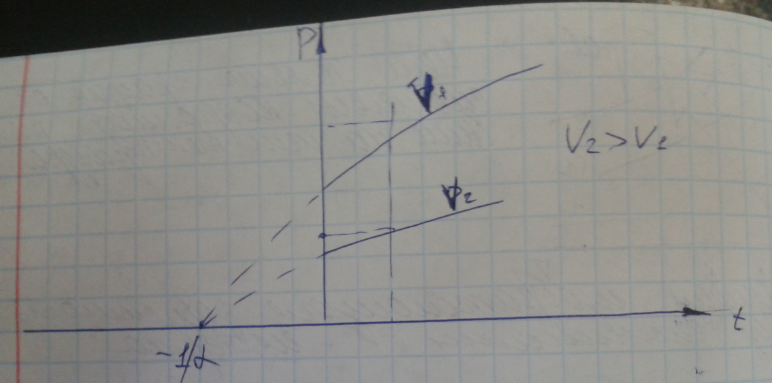
- Закон Авогадро:
Моли любых газов при одинаковых температуре и давлении занимают одинаковые объёмы.
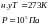
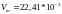
По определению: в одном моле различных веществ содержится одно и тоже число молекул называется постоянной Авогадро.
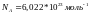
- Закон Дальтона:
Давление смеси газов равно сумме парциальных давлений входящих в смесь газов.
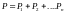
Парциальное давление это давление которое оказывал бы газ входящий в смесь если бы он один занимал объем равный объему смеси при той же температуре.
3 Вопрос. Уравнение Клапейрона-Менделеева.
Состояние
некоторой массы газа определяется тремя
термодинамическими параметрами
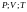
Между
параметрами существует определенная
связь, называемая уравнением состояния
идеального газа, которую в общем виде
можно задать выражением
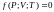 .
.
На
основании законов Бойля Мариотта и
Гей-Люссака французский физик Клапейрон
вывел уравнение состояния идеального
газа. Пусть некоторая масса газа занимает
объем
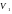 ,
имеет давление
,
имеет давление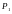 и находится при температуре
и находится при температуре
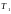 .
В другом произвольном состоянии эта же
масса газа характеризуется параметрами
.
В другом произвольном состоянии эта же
масса газа характеризуется параметрами .
Переход из состояния 1 в состояние 2
осуществляется в виде двух процессов:
изотермического
.
Переход из состояния 1 в состояние 2
осуществляется в виде двух процессов:
изотермического
 и
изохорного
и
изохорного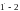 .
.
В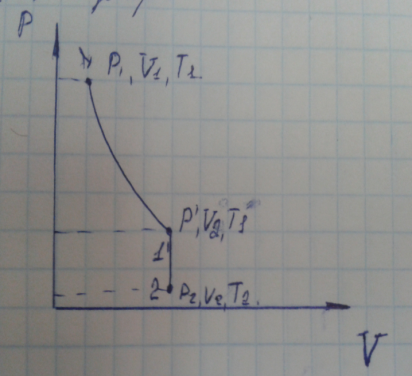 соответствии с законами запишем
соответствии с законами запишем
 .
.
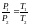 Решая совместно оба уравнения и исключая
из них
Решая совместно оба уравнения и исключая
из них
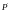 получим
получим
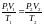 ,
так как точки 1 и 2 были выбраны произвольно,
то для данной массы газа величина
остается постоянной, то есть
,
так как точки 1 и 2 были выбраны произвольно,
то для данной массы газа величина
остается постоянной, то есть
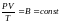 .
Данное выражение является уравнением
Клапейрона, где B - газовая
постоянная, различная для разных газов.
Менделеев объединил уравнение Клапейрон
с законом Авогадро. Согласно Авогадро
P и Т молей всех газов
занимает одинаковый молярный объем
.
Данное выражение является уравнением
Клапейрона, где B - газовая
постоянная, различная для разных газов.
Менделеев объединил уравнение Клапейрон
с законом Авогадро. Согласно Авогадро
P и Т молей всех газов
занимает одинаковый молярный объем
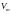 ,
поэтому постоянная В будет одинаковой
для всех газов. Обозначается она буквой
,
поэтому постоянная В будет одинаковой
для всех газов. Обозначается она буквой
 и называется молярной газовой постоянной:
и называется молярной газовой постоянной: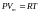 .
Этому уравнению удовлетворяет лишь
идеальный газ и оно называется
уравнением состояния идеального газа
или уравнение Клапейрона-Менделеева.
Числовое значении газовой постоянной
определяется из этого уравнения при
нормальных условиях для одного моля
газа.
.
Этому уравнению удовлетворяет лишь
идеальный газ и оно называется
уравнением состояния идеального газа
или уравнение Клапейрона-Менделеева.
Числовое значении газовой постоянной
определяется из этого уравнения при
нормальных условиях для одного моля
газа.

и
тогда
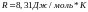 .
От данного уравнения можно перейти к
уравнению Клапейрона-Менделеева для
произвольной массы газа, если при
некоторых заданных давлений и температуре
1 моль занимает объём
,
то при тех же условиях масса газа
.
От данного уравнения можно перейти к
уравнению Клапейрона-Менделеева для
произвольной массы газа, если при
некоторых заданных давлений и температуре
1 моль занимает объём
,
то при тех же условиях масса газа
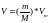 ,
где М - малярная масса или масса 1 моля
вещества. Тогда уравнение Клапейрона-Менделеева
имеет вид
,
где М - малярная масса или масса 1 моля
вещества. Тогда уравнение Клапейрона-Менделеева
имеет вид
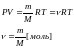
Часто
пользуются иной формой уравнения
состояния идеального газа вводя
постоянную Больцмана
 .
Тогда уравнение состояния имеет вид
.
Тогда уравнение состояния имеет вид
 .
.
 и n-называется концентрацией
молекул, то есть число молекул в единицы
объема.
и n-называется концентрацией
молекул, то есть число молекул в единицы
объема.
 .
При одинаковых температуре и давлении
все газы содержат в единице объема
одинаковое число молекул. Число молекул,
содержащихся в 1 кубометре газа при
нормальных условиях называются числом
Лошмидт.
.
При одинаковых температуре и давлении
все газы содержат в единице объема
одинаковое число молекул. Число молекул,
содержащихся в 1 кубометре газа при
нормальных условиях называются числом
Лошмидт.