
- •1 Вопрос. Параметры идеального газа.
- •2 Вопрос. Законы идеального газа.
- •3 Вопрос. Уравнение Клапейрона-Менделеева.
- •4 Вопрос. Изо-процессы с точки зрения уравнение Клапейрона-Менделеева.
- •5 Вопрос. Закон Максвелла о распределения молекул газа по скоростям и энергиям теплового движения.
- •6 Вопрос. Барометрическая формула. Распределение Больцмана.
- •7 Вопрос. Внутреннее трение вязкости.
- •8 Вопрос. Число степеней свободы. Внутренняя энергия.
- •9 Вопрос. Первое начало термодинамики.
- •10 Вопрос. Работа газа.
- •11 Вопрос. Теплоемкость.
- •12 Вопрос. Изобарный процесс.
- •13 Вопрос. Изохорный процесс.
- •14 Вопрос. Изотермический процесс.
- •15 Вопрос. Адиабатный процесс.
- •16 Вопрос. Круговой процесс (цикл).
- •17 Вопрос. Энтропия.
- •18 Вопрос. Второе начало термодинамики.
- •19 Вопрос. Цикл Карно.
- •Вопрос 20. Силы и потенциальная энергия межмолекулярного взаимодействия.
- •Вопрос 21. Уравнение Ван-дер-Ваальса.
- •Вопрос 22.Изотерма Ван-дер-Ваальса.
- •Вопрос 23. Внутренняя энергия реального газа.
- •Вопрос 24. Свойство жидкости.
- •Вопрос 25. Смачивание.
- •Вопрос 26. Давление от искривлённой поверхностью жидкости.
- •27 Вопрос. Капиллярное явлений.
- •28 Вопрос. Твердые тела.
- •Вопрос 29. Теплоемкость твердых тел.
- •Вопрос 30. Испарение, сублимация, плавление и кристаллизация.
- •Вопрос 31. Фазовые переходы 1 и 2 рода.
- •Вопрос 32. Диаграмма состояния. Тройная точка.
18 Вопрос. Второе начало термодинамики.
Первое
начало термодинамики, выражая закон
сохранения и превращение энергии. Не
позволяет при этом установить направление
протекания термодинамических процессах.
Второе начало термодинамики дает ответ
на вопрос какие процессы возможны в
природе а какие нет. Используя понятия
энтропии и неравенство Клаузиуса
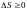 второе начало термодинамики можно
сформулировать как закон возрастания
энтропии: любой необратимый процесс в
замкнутой системе происходит так что
энтропия при этом возрастает или другими
словами в процессах проходящих в
замкнутых системах энтропия не убывает.
Формула Больцмана позволяет объяснит
второе начало термодинамики возрастание
энтропии означает переход системы из
менее вероятных в более вероятные.
второе начало термодинамики можно
сформулировать как закон возрастания
энтропии: любой необратимый процесс в
замкнутой системе происходит так что
энтропия при этом возрастает или другими
словами в процессах проходящих в
замкнутых системах энтропия не убывает.
Формула Больцмана позволяет объяснит
второе начало термодинамики возрастание
энтропии означает переход системы из
менее вероятных в более вероятные.
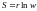 Термодинамическая
вероятность состояния системы это число
способов которые могут быть реализовано
данное состояние
Термодинамическая
вероятность состояния системы это число
способов которые могут быть реализовано
данное состояние
 .
Реальные процессы необратимы поэтому
можно утверждать что все процессы
замкнутой системы ведут к увеличению
энтропии. Существуют еще 2 формулировки
второго начало термодинамики. Формулировка
по Кельвину невозможен круговой процесс,
единственным результатом которого
является превращение теплоты полученный
от нагревателя в эквивалентную ей
работу. По Клаузиуса невозможен круговой
процесс, единственным результатом
которого является передача теплоты от
менее нагретого тела к более нагретому.
Первые два начала дают недостаточно
сведений о поведении термодинамических
систем при абсолютном 0 поэтому они
дополняются третьим началом термодинамики
или теоремой Нернста Планка энтропия
всех тел в состоянии равновесия стремится
к 0 по мере приближения температуры к
нулю Кельвина
.
Реальные процессы необратимы поэтому
можно утверждать что все процессы
замкнутой системы ведут к увеличению
энтропии. Существуют еще 2 формулировки
второго начало термодинамики. Формулировка
по Кельвину невозможен круговой процесс,
единственным результатом которого
является превращение теплоты полученный
от нагревателя в эквивалентную ей
работу. По Клаузиуса невозможен круговой
процесс, единственным результатом
которого является передача теплоты от
менее нагретого тела к более нагретому.
Первые два начала дают недостаточно
сведений о поведении термодинамических
систем при абсолютном 0 поэтому они
дополняются третьим началом термодинамики
или теоремой Нернста Планка энтропия
всех тел в состоянии равновесия стремится
к 0 по мере приближения температуры к
нулю Кельвина
 .
.
19 Вопрос. Цикл Карно.
Основываясь на второе начало термодинамики Карно вывел следующие теорему из все периодических действующих тепловых машин имеющих одинаковую температуры нагревателей Т1 и холодильников Т2 наибольшим КПД обладают обратимые машины при этом КПД машин работающих при одинаковых температурах Т1 и Т2 равны друг другу и не зависят от природы рабочего тела а определяются только температурами. Карно проанализировал цикл состоящий из двух изотерм и двух адиабат.
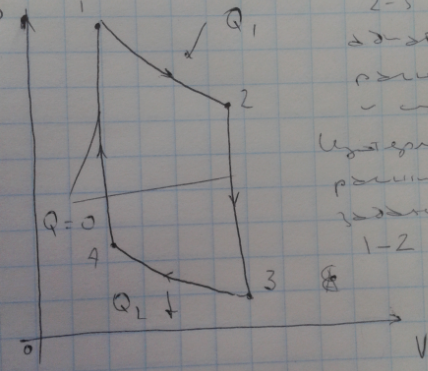
Изотермическое
расширение и сжатие 1-2, 3-4. А адиабатное
расширение 2-3, 4-1. При изотермическом
расширении U=const
и количество теплоты получаемым газом
Q1= работе расширения.
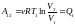 .
При адиабатном расширении отсутствует
тепло обмен а работа расширения
совершается за счет изменения внутренней
энергии
.
При адиабатном расширении отсутствует
тепло обмен а работа расширения
совершается за счет изменения внутренней
энергии
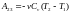 .
Количество теплоты отданная газом при
изотермическом сжатии равно работе
сжатия
.
Количество теплоты отданная газом при
изотермическом сжатии равно работе
сжатия
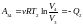 .
Работа адиабатного сжатия
.
Работа адиабатного сжатия
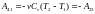 .
Работа совершаемая в результате кругового
процесса
.
Работа совершаемая в результате кругового
процесса
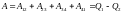 .
КПД цикла
.
КПД цикла
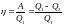 .
Применив уравнение Пуассона КПД цикла
Карно
.
Применив уравнение Пуассона КПД цикла
Карно
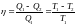 .
То есть определяется температурами
нагревателя и холодильника.
.
То есть определяется температурами
нагревателя и холодильника.
Вопрос 20. Силы и потенциальная энергия межмолекулярного взаимодействия.
Модель идеального газа, исп. в МКТ позволяет описывать поведение разряженных газов при достаточно высоких tоC и низких Р.
При рассмотрении реальных газов, т.е. газов, св-ва которых зависят от взаимод. молекул необходимо учитывать силы межмолекул. взаимод-я. они проявл. на расстояниях r меньше 10-9м и быстро убывают при увелич. расстояния между молекулами. Такие силы назыв. коротко действующими. По мере развития представлений о строении атома и квант механики было выяснено, что между молекулами в-ва одновременно действуют силы притяжения Fп и силы отталкивания Fот.
На расстоянии r=ro результирующая сила F=0, т.е. Fп и Fот уравновешивают друг друга, т.е. ro – расстояние, на котором находились бы молекулы при отсутствии теплового движения. При r больше ro преобладает сила притяжения, на расстояниях r меньше ro – силы отталкивания.
Элементарная работа силы F при увеличении расст. совершается за счёт уменьшения взаимной потенц. энергии молекул. Если молекулы находятся на расстоянии, на котором силы не действуют (R стремится к бесконечности).
При сближении молекул появляются силы притяжения, которые совершают положительную работу. Потенц. энергия уменьшается, достигая минимума, с уменьшением r силы отталкивания резко возрастают и совершаемая работа становится отрицательной. Критерием различных агрегатных состояний явл. соотношение между потенц. энергией и kT. Если Eп>kT, то в-во находится в тв. сост., т.к. молекулы не могут отдалиться на значит. расстояние и равновесие.
Если Eп много меньше kT, то в-во находится в газообразном состоянии, т.к. интенсивное тепловое движение молекул препятствует соед. молекул.
Если Eп примерно равна kT, то в-во находится в жидком сост., т.к. в результате теплового движ. молекулы перемещаясь в простр., обмениваясь местами, но не расходясь на расстояния, превышающее ro.
