- •II Семестр.
- •1)Магнитный поток. Опыты Фарадея. Явление электромагнитной индукции. Закон Фарадея для электромагнитной индукции. Правило Ленца. Вихревые токи(токи Фуко).
- •2)Индуктивность контура. Самоиндукция. Закон Фарадея для самоиндукции. Токи при размыкании и замыкании цепи.
- •3)Взаимная индукция. Энергия и объёмная плотность энергии магнитного поля.
- •4)Ток смещения.(Детлаф стр. 349)
- •5)Система уравнений Максвелла в интегральной форме и физический смысл входящих в неё уравнений. Электромагнитное поле как единство электрического и магнитного полей.
- •6)Гармонические колебания и их характеристики: период, частота, циклическая частота, амплитуда, фаза.
- •8)Свободные затухающие механические колебания, уравнение и характеристики.
- •9)Вынужденные механические колебания. Резонанс.
- •10)Сложение колебаний. Фигуры Лиссажу.
- •11)Продольные и поперечные волны в упругой среде. Звуковые волны.
- •12)Распространение волн. Фронт волны и волновая поверхность. Принцип Гюйгенса. Уравнение плоской бегущей волны. Длина волны.
- •15)Вынужденные электромагнитные колебания. Электрический резонанс.
- •16) Возникновение электромагнитных волн. Уравнение плоской электромагнитной волны. Энергия электромагнитной волны.
- •17) Шкала электромагнитных волн. Применение электромагнитных волн.
- •18)Когерентность и монохроматичность световых волн. Интерференция света от двух точечных когерентных источников. Условия наблюдения максимумов и минимумов при интерференции.
- •19) Кольца Ньютона. Применение интерференции. Интерферометры.
- •20)Дифракция света. Принцип Гюйгенса-Френеля. Метод зон Френеля. Дифракция Френеля на круглом отверстии.
- •21)Дифракция Фраунгофера на одной щели и на дифракционной решетке.
- •22)Дисперсия света. Опыт Ньютона. Нормальная и аномальная дисперсия.
- •23)Поляризация света. Естественный и поляризованный свет. Поляризация света при отражении и преломлении. Законы Брюстера и Малюса.
- •24)Тепловое излучение и его характеристики. Абсолютно черное тело(ачт). Закон Кирхгофа.
- •25)Законы Стефана-Больцмана и Вина.
- •26)Распределение энергии в спектре ачт. Формула Релея-Джинса и ‘ультрафиолетовая катастрофа’. Квантовая гипотеза Планка. Формула Планка.
- •27)Внешний фотоэффект. Вольт-амперная характеристика и законы внешнего фотоэффекта. Уравнение Эйнштейна для фотоэффекта.
- •2. Кинетическая энергия и скорость вырванных электронов линейно возрастают с частотой светового излучения и не зависят от его интенсивности.
- •3. Для каждого определенного материала, из которого изготавливается катод, существует определенное значение частоты, ниже которой фотоэффект не наблюдается( красная граница фотоэффекта).
- •28)Энергия и импульс фотона. Применение фотоэффекта. Корпускулярно-волновой дуализм света.
- •29)Модели атома Томсона и Резерфорда. Опыт Резерфорда. Ядерная модель атома.
- •30)Постулаты Бора.
- •31)Энергетический спектр атома водорода. Закономерности атомных спектров. Формула Бальмера.
- •32)Корпускулярно-волновой дуализм свойств микрочастиц. Гипотеза де Бройля и её экспериментальное подтверждение. Опыты Дэвисона и Джермера.
- •33)Принцип и соотношения неопределенностей Гейзенберга.
- •34)Волновая функция, её статистический смысл и условие нормировки. Уравнение Шредингера для стационарных состояний.
- •35)Квантовая частица в одномерной потенциальной яме.
- •36)Спонтанное и индуцированное излучение. Инверсная заселенность энергетических уровней.
- •37)Квантовые генераторы, их основные элементы и типы. Особенности лазерного излучения. Применение лазеров.
- •39)Собственная и примесная проводимости полупроводников.
- •41)Состав и характеристики атомных ядер. Дефект массы и энергия связи ядра. Ядерные силы.
- •42)Радиоактивное излучение и его виды. Закон радиоактивного распада.
- •43)Правила смещения при радиоактивных распадах. Законы сохранения при ядерных реакциях.
- •44)Цепная реакция деления. Коэффициент размножения нейтронов. Критическая масса. Атомная бомба и ядерный реактор.
- •45)Реакция синтеза атомных ядер. Неуправляемая термоядерная реакция.
- •46)Классификация элементарных частиц. Частицы и античастицы. Лептоны и адроны, кварки. Современная физическая картина мира.
- •2) По видам взаимодействий элементарные частицы делятся на следующие группы: Составные частицы
- •Фундаментальные (бесструктурные) частицы
30)Постулаты Бора.
Планетарная модель атома позволила объяснить результаты опытов по рассеиванию альфа-частиц, но встретилась с другой принципиальной трудностью.
Как известно, любое ускоренное движение электрических зарядов сопровождается излучением электромагнитных волн. Движение по окружности является ускоренным, поэтому электрон в атоме должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Это должно приводить к уменьшению энергии атома, к постепенному приближению электронов к ядру, и, наконец, к падению на ядро. Таким образом, атом, состоящий из ядра и обращающихся вокруг него электронов, неустойчив. Он существует только некоторое время, пока электроны не израсходуют свою энергию в процессе излучения волн и не упадут на ядро. Но в действительности атомы устойчивы. Это фактически означает, что к таким явлениям законы классической физики неприменимы.
Первый шаг на пути разрешения противоречий между теорией и результатами эксперимента в физике атома был сделан датским физиком Нильсом Бором. Свои представления об особых свойствах атомов Бор сформулировал в виде постулатов следующего содержания:
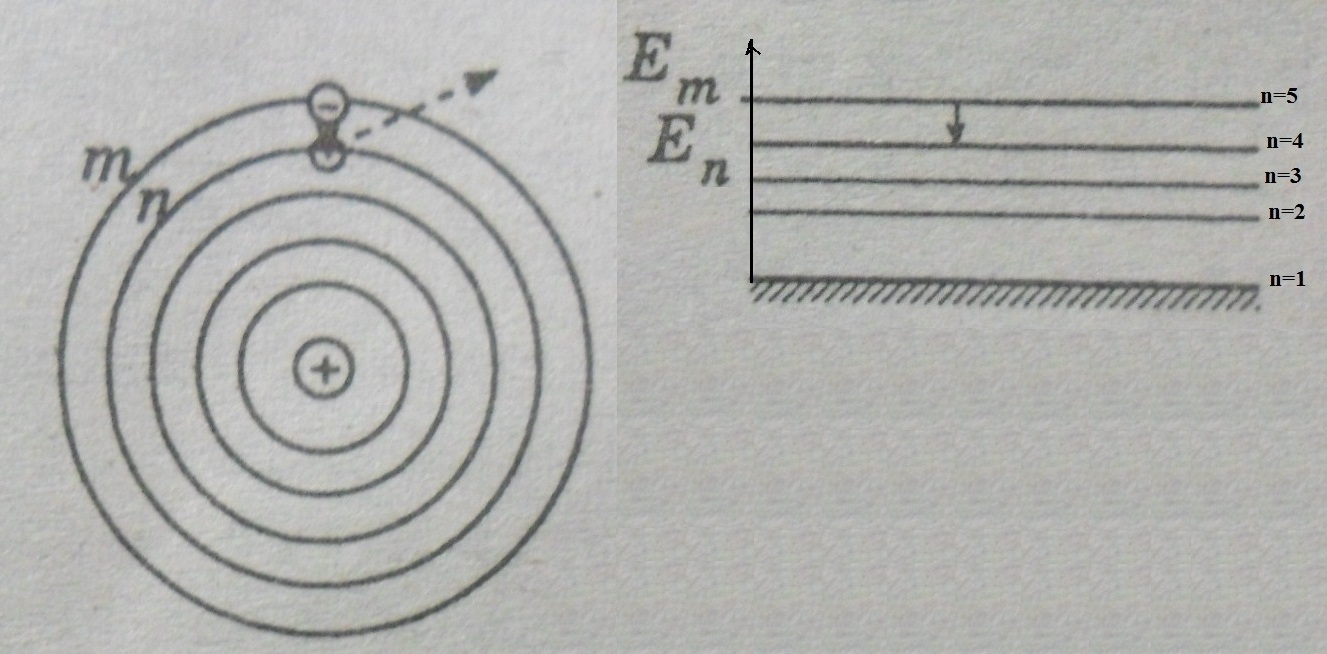
1)Существуют особые, стационарные состояния атомов, при которых электроны в атоме находятся на особой орбите и движутся с ускорением, но не излучают при этом электромагнитные волны. Каждому стационарному состоянию соответствует определенная энергия Е.
2)Излучение света происходит при переходе атома из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией (и наоборот при поглощении). Энергия излученного фотона равна разности энергий этих стационарных состояний
h*ν = ΔE.
Состояние атома, в котором он обладает минимальной энергией, называется основным. (n=1) Все остальные состояния называются возбужденными.
Если рассматривать это на простейшем примере, на атоме водорода, то получается, что сам по себе атом находится в невозбужденном состоянии, находясь на 1 энергетическом уровне, т.е. настолько близко к ядру, насколько только это возможно. Если атом начинает поглощать энергию, то он переходит на более высокие энергетические уровни, удаляется от ядра, т.е, согласно Бору, переходит от состояния с меньшей энергией, в состояние с большей. Если потом он начинает излучать свет, то теряет энергию и снова приближается к ядру. Для наглядного представления возможных энергетических состояний электронов в атомах используются энергетические диаграммы.
На энергетической диаграмме каждое стационарное состояние атома отмечается горизонтальной линией, называемой энергетическим уровнем.
Ниже всех остальных на диаграмме располагается энергетический уровень, соответствующий минимальному значению энергии из всех возможных. Когда электроны находятся на этом уровне, то атом в основном состоянии.
Переходы атома из одного состояния в другое изображаются вертикальными линиями между соответствующими уровнями на энергетической диаграмме, направление перехода указывается стрелкой. Вниз ( энергия становится меньше) – испускание света. Вверх (энергия становится больше) – поглощение.