
- •2. Квантово-механическая теория химической связи
- •Типы химических связей и их свойства.
- •3.1 Ковалентная связь
- •1) Обменному, когда каждый из соединяющихся атомов имеет на валентном уровне неспаренный электрон, который он предоставляет для образования общей электронной пары;
- •2) Донорно-акцепторному, когда один из соединяющихся атомов предоставляет электронную пару, а другой — вакантную орбиталь, на которой она может разместиться.
- •Параметры химической связи
3.1 Ковалентная связь
Наиболее распространенный тип связи – ковалентная связь.
Ковалентная связь образуется парой или несколькими парами электронов, обобществляемых между двумя соседними атомами.
Под «общей электронной парой» подразумевается сгусток электронной плотности, образующийся между двумя атомами в результате перекрывания электронных облаков принадлежавших им неспаренных электронов.
Образования общей электронной пары может осуществляться по двум механизмам:
1) Обменному, когда каждый из соединяющихся атомов имеет на валентном уровне неспаренный электрон, который он предоставляет для образования общей электронной пары;
2) Донорно-акцепторному, когда один из соединяющихся атомов предоставляет электронную пару, а другой — вакантную орбиталь, на которой она может разместиться.
1) Пример обменного механизма:
Образование двухатомной молекулы хлороводорода. Атомы водорода и хлора имеют следующие электронные конфигурации:
1Н, 1S1 17Cl, 1S22S22p63S23p5
При этом валентные электроны распределяются по орбиталям следующим образом:

Таким образом, и у водорода, и у хлора имеется по одному неспаренному электрону. Наличие на внешних орбиталях как неспаренных, так и спаренных электронов, т. е. двух электронов с противоположно направленными спинами. Образование из атомов водорода и хлора молекул НС1 можно изобразить следующей схемой:

На схеме общая для обоих соединяющихся атомов электронная пары обозначена двумя точками между символами элементов. Электронные пары, не используемые атомами для образования связи, обозначены парами точек около символа соответствующего элемента; такие электронные пары называют неподеленными. Этот способ изображения электронного строения молекул называют электронными формулами.
Ковалентная связь может быть полярной и неполярной.
Электроотрицательность элемента это способность атомов данного элемента оттягивать к себе общую электронную пару при образовании химической связи с атомами других элементов.
Таким образом, электроотрицательность характеризует способность атомов элемента удерживать электроны (как электроны своей электронной оболочки, так и дополнительные электроны — в случае неметаллов).
Если молекула образована двумя атомами с близкими значениями электроотрицательности, то распределение отрицательного заряда общего электронного облака более или менее симметрично. В предельном случае, если молекула образована двумя одинаковыми атомами, то отрицательный заряд электронов распределяется между ними поровну. В этом случае возникающая в молекуле связь неполярная.
Если соединяются два атома с различными значениями электроотрицательности, то облако отрицательного заряда общей электронной пары смещается в сторону более электроотрицательного атома, а образующаяся связь является полярной.
Атомы могут быть связаны между собой более чем одной электронной парой. Число электронных пар, связывающих два атома, называется кратностью связи между этими атомами. Простой (ординарной) связи соответствует одна общая электронная пара, двойной или тройной связи — соответственно две или три общие электронные пары.
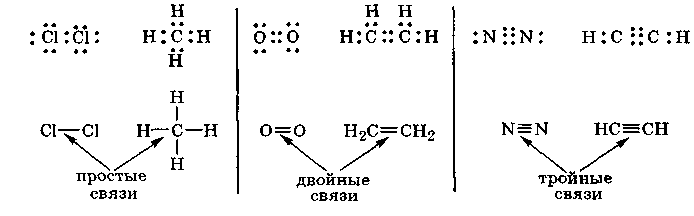
В ряде случаев число непарных электронов увеличивается в результате возбуждения атома, вызывающего распад двухэлектронных облаков на одноэлектронные. Например, атом углерода в основном состоянии имеет два непарных электрона (2s22p2), а при возбуждении одного из 2 s -электронов в 2р-состояние возникают четыре непарных электрона:

Вследствие этого атом углерода может соединяться, например, с четырьмя атомами фтора (2s22p5), имеющими по одному непарному электрону:

Возбуждение атомов до нового валентного состояния требует затраты определенной энергии, которая компенсируется энергией, выделяемой при образовании связей С—F.
Б) Рассмотрим пример донорно-акцепторного механизма образования ковалентной связи. Он характерен для взаимодействия частиц, одна из которых имеет пару электронов А:, другая — свободную орбиталь В:

Частица, предоставляющая для связи двухэлектронное облако, называется донором; частица со свободной орбиталью, принимающая эту электронную пару, называется акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома и свободной орбитали другого называется донорно-акцепторным.
Ионная связь
Если соединяются элементы, электроотрицательность которых сильно различается, т.е. один из них относится к числу наиболее электроположительных элементов (типичный металл), а другой - к числу наиболее электроотрицательных элементов (типичный неметалл), то валентный электрон (или электроны) электроположительного атома полностью переходит к электроотрицательному атому, в результате чего атомы превращаются в заряженные частицы – ионы. Атом, отдавший электроны, превращается в положительный ион (катион), а атом, принявший электроны, – в отрицательный ион (анион). Связь при этом будет осуществляться за счет взаимного притяжения противоположно заряженных ионов. Отсюда ее название – ионная связь.
Ионная связь – связь, образующаяся между атомами, электроотрицательность которых сильно различается.
Как правило, ионные связи образуют между собой элементы начала и конца периодов таблицы Менделеева. Это объясняется тем, что что различные атомы в различной степени способны принимать на свои орбиты электроны. Элементы седьмой группы, имеющие на внешней орбите семь электронов, легко принимают один электрон, недостающий до полного октета. Элементы же первой группы имеют на внешней орбите всего один электрон, который они легко отдают. Пример: образование хлорида натрия. Атом электроположительного элемента натрия, характеризующегося сравнительно невысокой энергией ионизации, легко теряет внешний электрон. Атом электроотрицательного элемента хлора, обладающего значительным сродством к электрону, напротив, способен принять на внешний электронный уровень дополнительный электрон. За счет электростатического притяжения между ионами возникает ионная связь.

В противоположность ковалентной связи, ионная связь не обладает направленностью и насыщаемостью.
Ионы можно представить как заряженные шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве. Поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении, сила притяжения зависит только от зарядов ионов и расстояния между ними. Иначе говоря, ионная связь характеризуется ненаправленностью.
П онятно,
что взаимодействие друг с другом двух
ионов противоположного знака не может
привести к полной взаимной компенсации
их силовых полей.
онятно,
что взаимодействие друг с другом двух
ионов противоположного знака не может
привести к полной взаимной компенсации
их силовых полей.
В силу этого у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям. К одному иону может притягиваться любое число ионов противоположного знака. Следовательно, ионная связь характеризуется ненасыщаемостью.
Ионная связь наиболее характерна для неорганических соединений. Отличительными чертами ионных соединений являются: мгновенность протекания реакций, диссоциация в водных растворах, высокие температуры плавления и кипения, растворимость в полярных растворителях, электрическая проводимость растворов и расплавов.
Отметим, что, если чисто ковалентная связь осуществима практически (например, в решетке алмаза, в молекуле водорода и т.п.), то ионная связь в чистом виде не встречается, т.к. величина потенциала ионизации атома даже наименее электроотрицательного элемента – Cs больше, чем значение сродства к электрону у наиболее электроотрицательного – F. Как следствие, во фториде цезия не происходит полной передачи электронов от Cs к F, а лишь на 93% . Это значит, что 7% времени связывающие электроны находятся в общем пользовании атомов данных элементов, т.е. связь на 7% ковалентная. В хлориде натрия связь лишь примерно на 80% ионная. Поэтому, уловились считать, что связь ионная, если ковалентная составляющая в ней менее 50%.
Металлическая связь
Металлическая связь – это связь между атомами в кристаллах металла.
У металлов имеется избыток валентных орбиталей и недостаток электронов. При сближении атомов в результате образования кристаллической решетки валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются из одной орбитали в другую, осуществляя связь между всеми атомами кристалла металла. Таким образом, в металлах небольшое количество электронов связывает большое количество атомных ядер. Связь является сильно делокализованной. Согласно одной из теорий металл можно рассматривать как плотно упакованную структуру из положительно заряженных ионов, связанных друг с другом электронным газом.
М еталлическую
связь нельзя отнести ни к ионному, ни к
ковалентному типу.
Например, литий кристаллизуется в
кубической объемно-центрированной
решетке, и каждый его атом имеет в
кристалле по восемь близлежащих соседних
атомов.
еталлическую
связь нельзя отнести ни к ионному, ни к
ковалентному типу.
Например, литий кристаллизуется в
кубической объемно-центрированной
решетке, и каждый его атом имеет в
кристалле по восемь близлежащих соседних
атомов.
Для образования ковалентной связи атом лития должен был бы представить восемь электронов, что невозможно, так как он имеет лишь один валентный электрон. В кристалле лития каждый атом представляет на связь четыре валентные орбитали и всего лишь один валентный электрон. Число электронов в кристалле значительно меньше числа орбиталей, кроме этого атомы металлов отличаются невысокой степенью ионизации – валентные электроны слабо удерживаются в атоме и легко перемещаются по всему кристаллу.
Возможность перемещения электронов по кристаллу определяет высокую электрическую проводимость металлов.
Практически не наблюдается чисто металлической связи, т.к. из-за электростатического притяжения ядер электроны чаще, чем в других областях пространства решетки металла, фиксируются между данными двумя атомами, образуя ковалентную связь. Причем, чем больше заряд ядра и меньше радиус атома, тем больше ковалентная составляющая связи и тем более прочен металл.
Водородная связь
Многочисленные экспериментальные данные свидетельствуют о том, что атом водорода способен соединяться одновременно с двумя другими атомами, входящими в состав разных молекул или одной и той же молекулы. С одним из атомов (А) водород обычно связан значительно сильнее (за счет ковалентной связи), чем с другим (В).


Последняя связь получила название водородной и обозначается тремя точками.
Водородная связь образуется между активными атомами водорода и сильно электроотрицательными атомами атому (фтор, кислород, азот, реже хлор, бром, сера). Активными называются атомы водорода, связанные с другим атомом сильно полярной ковалентной связью.
Возможность образования водородной связи является результатом особых свойств атома водорода, а именно – наличия у него одного единственного электрона. Если этот электрон полностью или частично переходит к другому атому, то остается в той или иной мере неэкранированный протон, т.е. частица с единичным положительным зарядом и очень малым радиусом. Это создает возможность протону очень близко подходить к неподеленной электронной параме, принадлежащей сильно электроотрицательному атому и взаимодействовать с ней. При этом атом водорода (положительный заряд) внедряется в электронное облако другого атома (отрицательный заряд).
Водородная связь по своему характеру в основном является электростатической. Ее энергия значительно ниже (в 15-20 раз) энергии ковалентной связи и равна 4-33 кДж/моль, тем не менее она в значительной мере определяет как химические, так и физические свойства соединений.
