
- •1 Основные положения теории электролитической диссоциации
- •Истинные и потенциальные электролиты
- •2) Гидратация этих ионов.
- •3 Степень диссоциации
- •4 Константа диссоциации
- •5 Ионные реакции
- •6 Ионное произведение воды. Водородный показатель
- •7 Буферные растворы
- •9 Гидролиз. Степень гидролиза. Константа гидролиза
- •Гидролиз солей, соответствующих сильному основанию и слабой кислоте
- •2. Гидролиз солей, соответствующих слабому основанию и сильной кислоте
7 Буферные растворы
Буферные растворы – это растворы, при добавлении к которым небольших количеств сильных кислот или щелочей значение рН не изменяется
А+ВАВ
рН=8
Буферные растворы являются 2-х компонентные системами и содержат:
– слабую к-ту и соль, образованную этой к-той и сильным основанием
Пример: Ацетатный буфер– СН3СООН (слабая к-та) + СН3СООNa
– Сильным основанием и слабой к-той: NaOH + H3BO3
– Слабым основанием и солью, образованной этим основанием и сильной кислотой.
Пример: Аммиачный буфер – NH4OH + NH4CL;
– Смесью солей.
Каждый буферный раствор поддерживает рН в строгом определенном диапазоне.
Например: Буферный раствор: СН3СООН + СН3СООNa, диапазон значений рН 3,85,6.
Конкретные значения рН зависит от соотношения компонентов.
Буферные растворы на основе оснований от 911.
Механизм действия буферных растворов
Действие буферных растворов основано на том, что что содержащиеся в них ионы связывают протоны и гидроксид-ионы, вводимые в р-р в малодиссоциированные соединения.
Рассмотрим механизм действия ацетатного буфера
СН3СООН СН3СОО– + Н+
(слабый электролит)
СН3СООNa СН3СОО– + Na+
(сильный электролит)
Если добавить Н+, то протоны связываться будут с СН3СОО– и образовываться будет кислота.
Если добавить ОН–, то гидроксид-ионы связываться будут с Н+ и образовываться будет Н2О, до определенного времени, а потом начнут накапливаться ОН– и изменится рН
Степень практической независимости рН от добавок кислоты или щелочи называют емкостью буферного раствора.
Емкость буферного раствора соответствует количеству эквивалентов сильной кислоты или сильного основания, которое необходимо добавить к 1 л раствора, чтобы его рН изменилось на 1. Емкость буферного раствора возрастает при увеличении начальных концентраций его компонентов и максимальна при их равенстве.

9 Гидролиз. Степень гидролиза. Константа гидролиза
Гидролиз –это разложение какого-либо вещества под действием воды.
Рассмотрим частный случай гидролиза - гидролиз солей. Гидролиз соли представляет собой реакцию, обратную реакции нейтрализации. Так, если гидролизуется соль, состоящая из катиона А и аниона В (для простоты примем их однозарядными), то имеет место обратимая реакция:


Чтобы гидролиз протекал необходимо, чтобы образовывался осадок.
Возможны, 3 варианта гидролиза:
– соль должна быть образована слабой кислотой и сильным основанием;
– соль должна быть образована слабым основанием и сильной кислотой;
– соль должна быть образована слабым основанием и слабой кислотой.
Соль образованная сильным основанием и сильной кислотой не подвергается гидролизу.
Количественными параметрами, характеризующими гидролиз является степень гидролиза (h) и Константа гидролиза (Кh)
Степень гидролиза
Степень гидролиза (h) – это отношение числа молекул соли, подвергшихся гидролизу к общему числу молекул соли введенных в раствор. Степень гидролиза может быть выражена в долях от нуля до единицы или в процентах.
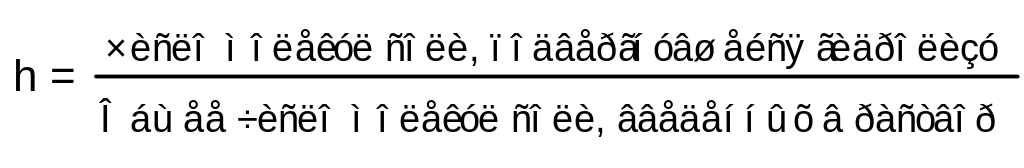
Степень гидролиза зависит от следующих факторов:
– природы соли. Чем более слабым электролитом является соль, тем сильнее идет гидролиз;
– концентрации соли. Чем меньше концентрация соли, тем меньше идет гидролиз;
– температуры. Чем выше температура, тем сильнее идет гидролиз;
– добавление к соли других веществ.
Если добавляемое вещество связывает продукты гидролиза, то гидролиз усиливается.
Если добавляемое вещество связывает исходные вещества или увеличивает концентрацию продуктов гидролиза, гидролиз ослабевает.
Константа гидролиза
Более универсальной характеристикой является Константа гидролиза (Кh,).
Константа гидролиза (Кh,) не зависит от концентрации соли и является постоянной для данной соли при данной температуре. Так как в разбавленных растворах концентрацию воды можно считать постоянной, то ее не записывают в выражение для константы, а вводят в численную величину Кh,наподобие того, как это делалось в случае Кw.
![]()

Рассмотрим три типичных случая гидролиза солей, причем для простоты катион и анион примем однозарядными.
