
- •Предмет и задачи кристаллохимии.
- •Общие свойства кристаллических веществ.
- •4. Вывод уравнения Вульфа-брегга, его использование.
- •Применение
- •5. Методы рентгеновской съёмки кристаллов.
- •6. Метод Дебая-Шеррера в рса, его использование.
- •7. Рентгенофазовый анализ.
- •9. Металлическая связь. Зонная теория Брилюэна.
- •10. Основные типы структуры металлов. Общие свойства металлов.
- •Общие физические свойства
- •11. Структура неметаллов. Правило Юм-Розери. Свойства кристаллических неметаллов.
- •13. Ионная связь. Энергия кристаллической решетки.
- •14. Размеры атомов и ионов. Ионные радиусы по Тольдшмидту и Полингу. Закономерности в изменении кристаллических радиусов.
- •15.Основные типы кристалличетских структур. Примеры.
- •16. Строение солей неорганических веществ. Структурные единицы.
- •17. Строение перовскита. Сегнетоэлектрики.
- •18. Строение шпинели. Ферромагнетики.
- •19. Строение и свойства силикатов. Цеолиты
- •20. Полиморфизм. Различие в строение полиморфных модификаций.
- •21. Изоморфизм. Твердые растворы замещения, твердые растворы внедрения.
- •22. Интерметаллические соединения: твердые растворы замещения, фазы Лавеса, внедрения, соединения Юм-Розери, «ионные» соедения.
- •24. Реальные кристаллы. Дефекты кристаллических решеток.
- •25. Физические свойства кристаллических веществ. Оптические свойства. Пьезоэлектрики. Влияние симметрии кристалла на его физические свойства.
- •26. Классификация кристаллических структур.
22. Интерметаллические соединения: твердые растворы замещения, фазы Лавеса, внедрения, соединения Юм-Розери, «ионные» соедения.
Интерметаллические соединения (металлические соединения, металлиды) - в узком смысле кристаллы, представляющие собой соединения металлов друг с другом; в широком смысле двух- или многокомпонентные кристаллы, электронное строение к-рых имеет характерные признаки металла (или полупроводника). Кристаллич. структуры И. с. отличаются от структуры отд. компонент. И. с. формируются из жидких, жидкой и твёрдой, твёрдых фаз, а также из неупорядоченного твёрдого раствора
Твердые растворы внедрения образуются при растворении в металле неметаллов с малым атомным диаметром (водород, азот, бор, углерод и др.). В твердых растворах внедрения углерода в железе условие не выполняется. Концентрация растворенного элемента в твердых растворах внедрения, как правило, не превышает 2 % При образовании твердых растворов внедрения кристаллическая решетка растворителя искажается и в ней возникают напряжения. Это приводит к повышению прочности, твердости и электросопротивления сплава.
При образовании твердых растворов замещения и внедрения размещение атомов растворенного элемента в решетке растворителя случайное, не закономерное.
Фазы Лавеса . Подавляющее большинство двойных фаз Лавеса имеют стехиометрический состав AB2, хотя имеются малочисленные исключения из этого правила. В настоящее время известно множество тройных интерметаллидов со структурой фаз Лавеса.
Структура фаз Лавеса:
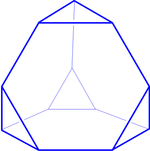
Лавесовский полиэдр
Фазы Лавеса образуются атомами двух сортов A и B, причем атом сорта A всегда имеет б́ольший атомный радиус (R), чем атом сорта B, причем существует идеальное соотношение радиусов компонентов RA:RB=1.225. К фазам Лавеса относятся соединения, кристаллизующиеся в несколько родственных структурных типов, из которых наиболее многочисленными являются три нижеследующих:
гексагональный тип MgZn2 пространственная группа P63/mmc, 12 атомов в элементарной ячейке;
кубический тип MgCu2, пространственная группа Fd3m, 24 атома в элементарной ячейке;
гексагональный тип MgNi2 , пространственная группа P63/mmc, 24 атома в элементарной ячейке.
Все эти структуры имеют схожее расположение атомов, которое проявляется в идентичных координационных полиэдрах (многогранник, образованный атомами одного сорта вокруг атомов другого). Так, во всех фазах Лавеса координационный полиэдр вокруг атома сорта A представляет собой так называемый Лавесовский полиэдр (см. рисунок), имеющий форму усечённого тетраэдра. Сами же атомы сорта A располагаются в алмазоподобной подрешётке. Все фазы Лавеса являются политипами, то есть имеют разный порядок укладки одинаковых структурных единиц, в качестве которой в данном случае выступает многослойный «сэндвич». Так кубическая фаза Лавеса MgCu2 представляет собой трёхслойную укладку элементарных структурных единиц в порядке …ABCABC…, фаза MgZn2 является двухслойной …ABAB…, а фаза MgNi2 — четырёхслойной …ABACABAC… . Поскольку возможны (хотя и редко встречаются) и другие последовательности укладки слоёв, то семейство фаз Лавеса является более многочисленным. Всего же к фазам Лавеса относится не менее 1000 различных интерметаллических соединений
Согласно полуэмпирическим правилам Юм-Розери, непрерывный ряд твёрдых растворов замещения в металлических системах образуются лишь теми элементами, которые, во-первых, имеют близкие по размерам атомные радиусы (отличающиеся не более чем на 15 %) и, во-вторых, находятся не слишком далеко друг от друга в электрохимическом ряду напряжений. При этом элементы должны иметь один и тот же тип кристаллической решетки. В твёрдых растворах на основе полупроводников и диэлектриков, благодаря более «рыхлым» кристаллическим решеткам образование твёрдых растворов замещения возможно и при большем различии атомных радиусов. Юм-Розери постулировал, что отношение общего числа валентных электронов к общему числу атомов в эмпирической формуле металлического соединения должно соответствовать отношению некоторых целых чисел, а именно 3 : 2 для Р-структур, 21 : 13 для уструктур и 7 : 4 для е-структур. Это правило справедливо для многих двойных и тройных соединений. Однако оно более характерно для металлических соединений, имеющих область составов, включающую идеальный состав, который удовлетворяет требованию правила Юм-Розери.
Ионные соединения представляют собой твердые неорганические диэлектрики с ионным типом химической связи. Для этой группы соединений характерны кроме электронной, ионная и электронно-релаксационная поляризации. Принято выделять группу диэлектриков с быстрыми видами поляризаций электронной и ионной, и с замедленными видами поляризаций релаксационного типа, накладывающихся на электронную и ионную поляризации. К первой группе, в которой наблюдаются только быстрые виды поляризаций, относятся кристаллические вещества с плотной упаковкой ионов. К ним относятся каменная соль, кварц, слюда, корунд и др. Ко второй группе, в которой кристаллические диэлектрики с неплотной упаковкой ионов в решетке имеют также и ионно-релаксационную поляризацию, относятся неорганические стекла, электротехнический фарфор, ситаллы, микалекс и др.
23. молекулярные кристаллы. Структура кристаллов органических веществ.
МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ, образованы молекулами, связанными ван-дер-ваальсовыми силами. Внутри молекул атомы соединены существенно более прочными (ковалентными) связями.
Фазовые переходы молекулярных кристаллов - плавление, возгонка, полиморфные переходы - происходят, как правило, без разрушения отдельных молекул. Молекулярные кристаллы являются частным случаем ван-дер-ваальсовых кристаллов, к которым относятся также цепочечные и слоистые кристаллы, где посредством ван-дер-ваальсовых сил соединены бесконечные цепи (напр., орг. полимеры) или слои (напр., графит). Структуру молекулярных кристаллов, как и др. кристаллич. в-в, устанавливают с помощью рентгеновского структурного анализа; для изучения динамики молекул в молекулярных кристаллах используют колебат. спектроскопию и неупругое рассеяние нейтронов.
Молекулярные кристаллы образуют орг., металлоорг., мн. комплексные соед., а также бинарные соединения типа Н2О, СО2, НСl и др. В форме молекулярных кристаллов могут находиться нек-рые твердые простые в-ва (напр., Н2, галогены, N2, O2, S8). Кристаллы благородных газов также молекулярные, построены из одноатомных молекул. Молекулярные кристаллы делятся на гомомолекулярные и гетеромолекулярные. Первые состоят из одинаковых молекул, вторые-из разных. К числу гетеромол. кристаллов относятся, напр., кристаллогидраты орг. соединений, мол. комплексы типа нафталин-тетрацианоэтилен, твердые р-ры орг. в-в.
Укладка молекул в молекулярные кристаллах осуществляется по принципу плотной упаковки. Стремление к плотной упаковке часто приводит к тому, что молекула в кристалле утрачивает собств. элементы симметрии (кроме центра симметрии), однако из-за слабости межмолекулярных ван-дер-ваальсовых взаимод. по сравнению с ковалентными связями искажения собств. симметрии невелики. Типичный пример-нафталин, своб. молекула к-рого кроме центра имеет три зеркальные плоскости симметрии, но в кристалле сохраняется лишь центр - плоскости симметрии утрачиваются, что проявляется в небольших искажениях длин связей и валентных углов. Молекула с центром симметрии в кристалле практически всегда располагается в центре кристаллич. симметрии (правило центросимметричности).
Наряду с обычными ван-дер-ваальсовыми взаимод. в молекулярных кристаллах наблюдаются направленные межмолекулярные взаимод., к-рые могут значительно повышать абс. величину энергии кристаллич. структуры. Наиб. распространенными из таких взаимод. является водородная связь (кристаллы льда, спиртов, карбоновых к-т, аминокислот и др.). Кроме того, известны, напр., взаимод. между атомами галогенов соседних молекул, атомами металла, а также атомами металла и кислорода в хелатах. Межмолекулярные взаимод. влияют на тип упаковки молекул и часто приводят к сокращению межмол. контактов по сравнению с суммой ван-дер-ваальсо-вых атомных радиусов. Для типичных молекулярных кристаллов характерны низкие т-ры плавления, большие коэф. теплового расширения, большая сжимаемость, малая твердость. Большинство молекулярных кристаллов при комнатной т-ре-диэлектрики. У ряда молекулярных кристаллов (напр., орг. красителей) наблюдаются полупроводниковые св-ва.
