
- •Внутрикомплексные соединения
- •Ионная сила раствора
- •Перманганатометрия
- •Хроматометрия
- •Иодометрия
- •Кислотно-основное титрование
- •Электродный потенциал.
- •Кулонометрическая генерация титранта
- •32. Потенциометрия. Разновидности метода. Типы электродов в потенциометрии.
- •33. Потенциометрическое титрование. Способы определения конечной точки титрования.
- •34. Амперометрическое титрование. Кривые титрования.
- •35. Атомно-эмиссионный анализ. Источники атомизации и возбуждения. Качественный и количественный анализ. Уравнение Ломакина-Шайбе.
- •37. Метод молекулярной абсорбционной спектроскопии (фотоколориметрия)
- •38. Электрохимические методы анализа. Общая характеристика и классификация электрохимических методов.
- •40. Прямая потенциометрия. Уравнение Нернста. Индикаторные электроды. Ионометрия : определение pH, ионов щелочных металлов, галогенид-ионов.
Ионная сила раствора
Мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:

где cB — молярные концентрации отдельных ионов (моль/л-3), zB заряды ионов
Суммирование проводится по всем типам ионов, присутствующих в растворе. Если в растворе присутствуют два или несколько электролитов, то вычисляется общая суммарная ионная сила раствора.
Например, для раствора NaCl с концентрацией 0,001 моль/л, в котором присутствуют два вида однозарядных ионов Na+und Cl- с концентрациями также равными 0,001 моль/л, ионная сила будет вычисляться следующим образом:
I(NaCl) = 0,5(z2(Na+)•c(Na+) + z2(Cl-)•c(Cl-) ) = 0,5(12•c(NaCl) + (-1)2•c(NaCl) ) = c(NaCl)
И ионная сила соответсвенно будет равна концентрации раствора:
I = 0.5(12•0,001 моль/л + (-1)2•0,001 моль/л) = 0.5(0,001 моль/л + 0,001 моль/л) = 0,001 моль/л
Это верно для раствора любого сильного электролита, состоящего из однозарядных ионов. Для электролитов, в которых присутсвуют многозарядные ионы, ионная сила обычно превышает молярность раствора.
Ионная сила раствора имеет большое значение в теории сильных электролитов Дебая — Хюккеля. Основное уравнение этой теории (предельный закон Дебая — Хюккеля) показывает связь между коэффициентом активности иона ze и ионной силы раствора I в виде:
![]()
где γ - коэффициент активности, А - постоянная, не зависящая от заряда иона и ионной силы раствора, но зависящая от диэлектрической постоянной растворителя и температуры.
7.


8.




9.



10.


11. 11)Комплексонометрическое титрование.Определение жесткости воды.
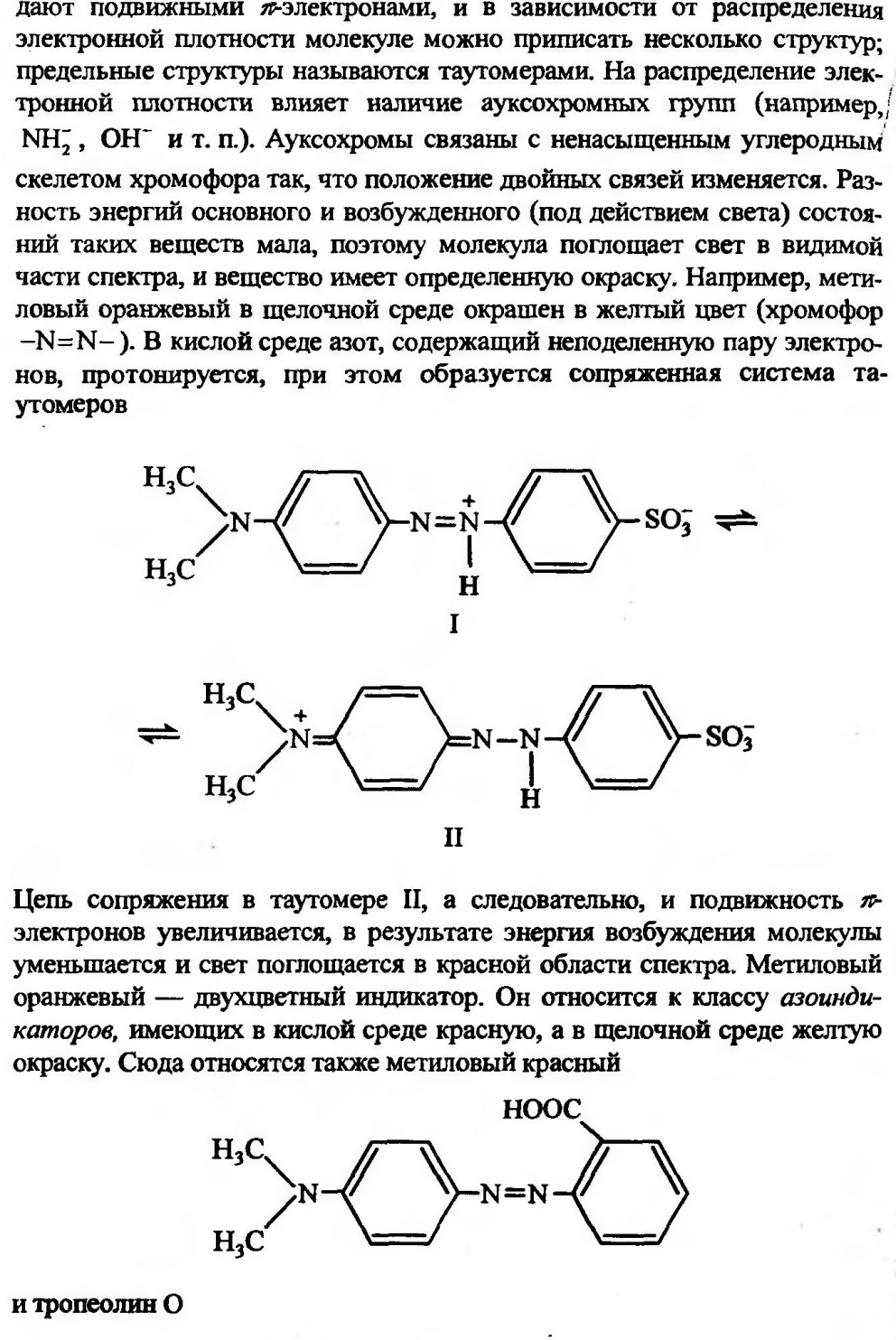
Метод комплексонометрического титрования (комплексонометрия) основан на реакции образования внутрикомплексных соединений ионов металлов со специальными комплексообразующими органическими реагентами – комплексонами, в частности, аминополикарбоновыми кислотами и их солями. Комплексоны образуют с ионами металлов прочные комплексы состава 1:1 (комплексонаты), что исключает ступенчатое комплексообразование и упрощает анализ и сопутствующие ему расчеты. Метод комплексонометрического титрования обладает высокой чувствительностью (до 10-3 моль/л) и точностью (погрешность 0,1-0,3%), быстр и прост в исполнении, имеет достаточно высокую избирательность (селективность), что обеспечило его широкое применение в практике химического анализа.
В фармации комплексонометрическое титрование используют для количественного определения препаратов кальция (хлорид, глюконат, лактат и др.), цинка (оксид и сульфат, цинк-инсулин), железа (глицерофосфат, лактат, сахарат, аскорбинат, сульфат и др.), кобальта (цианкобламин, коамид, ферковен), препаратов, содержащих соли магния, висмута, ртути, свинца и других металлов Широко применяют комплексонометрию при анализе воды, в частности, при определении её жесткости, обусловленную присутствием солей кальция и магния. При анализе различных минералов и растительного сырья метод комплексонометрического титрования позволяет проводить определение разных элементов при их совместном присутствии. Большое значение комплексонометрия имеет при анализе промышленных отходов и сточных вод, а также при определении экологической чистоты природных объектов. Косвенной комплексонометрией методами обратного и заместительного титрования можно определять анионы (сульфаты, фосфаты, арсенаты, оксалаты и др.), образующие малорастворимые соединения с катионами, титруемыми комплексонами.
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»).
Для определения жесткости могут быть использованы:
а) визуально-колориметрический метод, пригодный для анализа воды с очень малой жесткостью порядка десятых долей микрограмм – эквивалента в литре;
б) объемный олеатный метод, применяемый относительно редко, обычно в тех случаях, когда трилонатный метод оказывается неэффективным.
в) кислотно-основное титрование.
Колориметрический метод
Этот метод основан на различной интенсивности окраски хром темно – синего в зависимости от концентрации ионов Са2+ и Mg2+ в анализируемой воде и может быть использован для быстрого определения малых жесткостей воды (от 10 мкг – экв/л).
Олеатный метод
Этот метод основан на малой растворимости олеатов кальция и магния. Поэтому добавление раствора олеата калия к анализируемой пробе воды и ее взбалтывание вызывает сначала осаждение всех содержащихся в воде ионов кальция и магния в виде олеата, и лишь затем избыток олеата калия приводит к образованию устойчивой пены, что и служит признаком окончания титрования.
Минимальное количество олеата, уже вызывающее при взбалтывании пробы воды появление пены, зависит от концентрации в ней ионов кальция и магния. Эта зависимость не имеет характера прямой пропорциональности и является более сложной, что указывает на отсутствие простых стехиометрических соотношений при взаимодействии олеата калия с ионами щелочноземельных металлов.
Отсутствие стехиометрической закономерности не является, однако, препятствием для использования олеатного метода в целях определения жесткости, так как при соблюдении точного оговоренных условий в отношении температуры титруемой жидкости, ее объема, величины рН, частоты и интенсивности взбалтывания, характера пены, скорости прибавления олеатного раствора и т.д. можно получать этим методом хорошо воспроизводимые результаты.
Олеатный метод определения жесткости применим для анализа вод, жесткость которых не превышает 0,5 мг–экв/л. Наименьшая жесткость, которая может быть достаточно надежно зафиксирована олеатным методом, составляет 2 мкг – экв/л. Таким образом, чувствительность этого метода практически такая же, как и трилонометрического.
Метод кислотно-основного титрования
В основе кислотно-основного титрования в водных растворах лежат реакции взаимодействия между кислотами и основаниями:
Н+ + ОН– = Н2О
С помощью этого метода прямым титрованием можно определить концентрацию кислоты или основания или содержание элементов, образующих кислоты или растворимые основания (например, фосфора – в виде фосфорной кислоты, мышьяка – в виде мышьяковой кислоты и т.п.)
Обратным титрованием или косвенными методами находят содержание некоторых солей (например, солей аммония, кальция и др.). Применяя специальные приемы, титруют смеси кислот с их солями, смеси кислых и средних солей и т.д.
12.
Кислотно-основные индикаторы — органические соединения, способные изменять цвет в растворе при изменении кислотности (pH). Индикаторы широко используют в титровании в аналитической химии и биохимии. Их преимуществом является дешевизна, быстрота и наглядность исследования. Однако из-за субъективности определения цвета и невысокой точности индикаторы pH не всегда удобны; поэтому для точного измерения pH используют pH-метры с цифровой индикацией
![]()
![]()
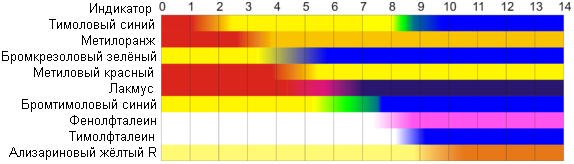
Интервалы перехода цвета индикаторов
На рисунке приведены ориентировочные данные о существовании разных цветных форм индикаторов в водных растворах.
Формы применения индикаторов
Индикаторы обычно используют, добавляя несколько капель водного или спиртового раствора, либо немного порошка (например, смесь мурексида с хлоридом натрия) к пробе исследуемого раствора. Так, при титровании, в аликвоту исследуемого раствора добавляют индикатор, и наблюдают за изменениями цвета в точке эквивалентности.
Другой способ применения - использование полосок бумаги, пропитанных раствором индикатора или смеси индикаторов и высушенных (например, "Универсальный индикатор"). Такие полоски выпускают в самых разнообразных вариантах - с нанесенной на них цветной шкалой - эталоном цвета (в том числе для окрашенных или мутных сред), или с напечатанными числовыми значениями рН; для точного измерения в узких диапазонах рН, и для ориентировочного исследования растворов; в рулончиках, коробках и пеналах, или в виде отрывных книжечек.
Современные индикаторные полоски могут быть изготовлены с красителем - индикатором, привитым к целлюлозе или иному полимеру. Это делает их устойчивыми к вымыванию, вплоть до многократного использования.
рТ – показатель титрования – это опытное значение рН титруемого раствора, при котором наблюдается наиболее резкое изменение окраски индикатора, свидетельствующее об окончании титрования.
13 и 14.

