
- •Содержание
- •Билет №1
- •2. Определение катаболизма. Катаболизм и анаболизм. Стадии катаболизма биомолекул в организме.
- •Билет№2.
- •1.Ферменты. Специфичность ферментов. Активный центр фермента.
- •2.Экзергонические и эндергонические биохимические реакции. Роль атф и других макроэргических фосфатов в сопряжении экзергонических процессов и эндергонических процессов.
- •3.Пути внутриклеточного метаболизма глюкозы. Гликолиз и глюконеогенез. Обратимые и необратимые реакции.
- •Билет №3
- •1.Регуляция активности ферментов. Проферменты. Изоферменты. Ингибиторы ферментов.
- •2.Реакции биологичемкого окисления.Типы реакций( дегидрогеназные, оксидазные, оксигеназные. Их биологическое значение.
- •3 Цитохромы Катализируют окисление веществ путем отдачи электронов Гемовое железо в одном из цитохромов имеется так же атом меди.
- •Билет№4
- •1.Ферментативный катализ
- •2.Митохондриальный транспорт
- •3.Аэробное окисление пирувата (окислительное декарбоксилирование пировиноградной кты).
- •Билет№5
- •1.Кинетика ферментативного катализа. Уравнение Михаэлиса-Ментен. Уравнение Лайнуивера-Берка.
- •2.Окислительное фосфорилирование. Пункты сопряжения окисления и фосфорилирования. Атф-синтетаза митохондрий.
- •3 Субъединицы (γ,δ,ε) способствуют целостности атф-синтазы
- •3.Полное окисление глюкозы. Энергетический баланс
- •Билет№6
- •1.Аллостерические ферменты. Ингибиторы и активаторы аллостерических ферментов. Аллостерические центры.
- •Деградация жирных кислот: β-окисление
- •Билет№7
- •1.Опять ферменты
- •2. Ингибиторы и разъединители транспорта электронов окислительного фосфорилирования
- •3.Глюконеогенез
- •Билет №8
- •1. Витамины
- •2. Микросомальная цепь транспорта электронов
- •3. Глюкозолактонный цикл
- •1. Витамин в2
- •3.Гипергликемия
- •Билет 10
- •Билет 11
- •1. Витамин в6(пиридоксин, пиридоксаль, пиридоксамин)
- •3 Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
- •Билет 12
- •1.Биотин
- •2. Нарушение обмена гликогена
- •3. Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
- •Билет 13. Фолиевая кислота. Биологическая роль. Пути поступления в организм. Коферментная функция.
- •2.Катаболизм триацилглицеролов. Реакции, механизм регуляции активности триглицеридлипазы. Нейрогуморальная регуляция липолиза (адреналин, глюкагон, инсулин).
- •3.Трансаминирование амк. Аминотрансферазы. Отдельные аминотрансферазы. Реакции. Биохимическое значение трансаминирования амк.
- •Билет 14
- •1.Витамин в12. Биологическая роль. Пути попадания в организм. Коферментная функция.
- •3.Пути превращения аммиака в организме человека. Механизмы обезвреживания аммиака.
- •Билет №15
- •1.Витамин с.
- •2.Окисление пальмитиновой кослоты.
- •3.Биосинтез мочевины.
- •Билет №16
- •1.Витамин а.
- •2.Окисление ненасыщенных жирных кислот.
- •3.Превращение безазотистого скелета ак
- •Билет №17
- •1.Витамин д
- •2. Биосинтез высших жирных кислот.
- •3. Метаболизм ак с разветвленной цепью.
- •Билет №25 Репликация днк
- •Свойства процесса репликации:
- •Желчные кислоты
- •Стероидные гормоны
- •2.Специализированные пути метаболизма цикл. А,к- фенилаланина и тирозина.. Заболевания, связанные с нарушением обмена фенилаланина и тирозина.
- •3.Биосинтез гема
- •Билет 19
- •2.Биосинтез пуриновых нуклеотидов
- •3.Основные закономерности генетического кода. Адапторная гипотеза ф. Крика и её развитие в wobble-гипотезе.
- •Билет №20
- •2. Кинетика ферменативного катализа. График зависимости скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента.
- •Билет №21
- •Транскрипционные факторы: Механизмы действия тф , связавающиеся с днк, могут влиять на транскрипцию генов через несколько механизмов:
- •Билет№22
- •Билет 23
- •2. Полное окисление глюкозы. Энергетический баланс полного окисления глюкозы.
- •Билет№24
- •1.Антибиотические вещества, подавляющие синтез белка
- •24.2 Функционирование малат-аспартатного и глицерофосфатного шунта.
- •Билет №26
- •3. Окисление капроновой кислоты
- •Билет №27
- •Репликация
- •Билет 28
- •Билет29
- •29.2.Метаболизм аминокислот
- •Билет №30
- •1.Особенности молекулярной организации и экспрессии генома эукариот (экзоны, интроны, сплайсинг)
- •2.Образование кетоновых тел и их утилизация.
- •3.Цикл трикарбоновых кислот. Реакции
2.Реакции биологичемкого окисления.Типы реакций( дегидрогеназные, оксидазные, оксигеназные. Их биологическое значение.
ислительнымпутемра зрыва ется основное количество химических святей питательных веществ Например аминокислоты образующиеся при гидролизе белка расщепляются затем до углекислого газа воды и аммиака Какие же способы окисления веществ реализуются в клетке?
Соединения могут окислятся по современным представлениям тремя различными способами
1 Реакции оксиденации Т е окисление путем прямого присоединения кислорода к окисляемому субстрату 2 Путь передачи электронов Некоторые реакции окислительные сопровождаются только потерей электронов, а затем происходит присоединение протонов 3 главный (основной) Путем отщепления атомов водорода от окисляемого субстрата - дегидрирование Принято различать 2 вида дегидрирования
а) Аэробное б) Анаэробное
В чем различие? Суть различия сводится к вопросу о первичном акцепторе отщепленного водорода Если атомы водорода отщепленные от субстрата переносятся сразу на кислород - аэробное Если отщепленные атомы водорода переносятся на соединения отличные от кислорода - анаэробное
Классификация фермента» участвующих в биоокислении. Оксиредуктазы Все ферментыкатализирующ ие окислительно-восстан овите льные процессы Какие же здесь группы
1 Отщепление атомов водорода от окисляемого субстрата катализируется ферментами оегиАрогинюами Их разделяют на 2 подподкласса
а) Аэробные дегидрогиназы
б) Анаэробные дегидрогиназы
В чем разница между ними? Аэробные дегидропшазы катализируют перенос отщепленных атомов водорода от окисляемого субстрата на кислород в итоге образуется токсичная перекись водорода
H-S-H + О2 -> S окисл + Н2О2
Анаэробные дегидрогиназы катализируют перенос отщепленных атомов водорода на какое-то соединение отличающееся от кислорода (НАД, ФАД, ФМН), а субстрат окисляется, потеряв 2 атома водорода
H-S-H + X ->ХН2 + Зокисл
2 Оксигеназы Ферменты катализирующие присоединение кислорода или реакцию оксидинации Принято длить на 2 группы
а) Монооксигеназы (гидроксилазы) присоединяют атомарный кислород к окисляемому субстрату
б) Дноксигеназы присоединяют молекулу кислорода а) р
H-S + О2 + КН2 -» S ^H2O + Кокисл
Реакции монооксигеназного типа требуют еще одного участника так называемого Косубстрата Чаще всего выступает восстановленный НАД К субстрату присоединяется один атом кислорода
б) H-S-H + О2 >HO- S-OH ->S--O + H2O
3 Цитохромы Катализируют окисление веществ путем отдачи электронов Гемовое железо в одном из цитохромов имеется так же атом меди.
4 Вспомогательные ферменты биологического окисления К ним относятся такие ферменты как католаза и пероксидаза. которые играют защитную роль разрушая перекись водорода или органические перекиси образующихся в ходе окислительных процессах Перекиси представляют собой достаточно агрессивные соединения которые могут вызвать значительные изменения в клеточных структурах
ФУНКЦИИ БИОЛОГИЧЕСКОГО ОКИСЛЕНИЯ
1 Важнейшей функцией биологического окисления является несомненно высвобождение энергии которая в дальнейшем используется в эндоорганических процессах
2 В ходе окисления питательных веществ образуется ряд низкомолекулярных соединений, которые клетка использует потом для биосинтеза Назыв - пластическая функция Например синтез аминокислот из продуктов окисления глюкозы или жиров используется в биосинтетических реакциях Генерация восстановительных эквивалентов (потенциалов).
Окислительные процессы несут защитную роль Многие ксенобиотики обезвреживаются путем окисления в том числе многие лекарственные препараты
5. Огромная роль в поддержании температуры тела Таким образом существование живых существ невозможно без окислительных процессов..
3. Ферменты биологического окисления в митохондриях. НАД- и ФАД-зависимые дегидрогеназы. Цитохромы.
Компоненты дыхательной цепи во внутренней мембране михохондрий формируют комплексы:
I комплекс (НАДН-КоQН2-редуктаза) – принимает электороны от митохондриального НАДН и транспортирует их на КоQ. Протоны транспортируются в межмембранное пространство. Промежуточным акцептором и переносчиком протонов и электронов являются ФМН и железосерные белки. I комплекс разделяет поток электронов и протонов.
II комплекс – сукцинат – КоQ - редуктаза – включает ФАД- зависимые дегидрогеназы и железосерные белки. Он транспортирует электроны и протоны от флавинзависимых субстратов на убихинон, с образованием промежуточного ФАДН2.
Убихинон легко перемещается по мембране и передает электроны на III комплекс.
III комплекс – КоQН2 - цитохром с - редуктаза – имеет в своем составе цитохромы b и с1, а также железосерные белки. Функционирование КоQ с III комплексом приводит к разделению потока протонов и электронов: протоны из матрикса перекачиваются в межмембранное пространство митохондрий, а электроны транспортируются далее по ЦТД.
IV комплекс – цитохром а - цитохромоксидаза – содержит цитохромоксидазу и транспортирует электроны на кислород с промежуточного переносчика цитохрома с, который является подвижным компонентом цепи.
Существует 2 разновидности ЦТД:
Полная цепь – в нее вступают пиридинзависимые субстраты и предают атомы водорода на НАД-зависимые дегидрогеназы
Неполная (укороченная или редуцированная) ЦТД в которой атомы водорода передаются от ФАД-зависимых субстратов, в обход первого комплекса.
Никотинзависимые дегидрогеназы, содержащие в качестве коферментов НАД+ или НАДФ+ . НАД+ и НАДФ+ - производные витамина РР. Субстраты, от которых происходит отщепление (дегидрирование) протонов Н+ и ē на НАД- и НАДФ- зависимые дегидрогеназы находятся в цитоплазме и в матриксе митохондрий. Рабочей частью НАД и НАДФ служит никотинамид (вит. РР). В окисленной форме никотинамидные коферменты обозначают как НАД+ или НАДФ+ , так как они несут положительный заряд на атоме азоте пиридинового кольца. В реакциях дегидрирования из двух атомов водорода, отщепляемых от окисляемого субстрата, никотинамидное кольцо присоединяет ион водорода и два электрона, второй ион водорода переходит в среду.
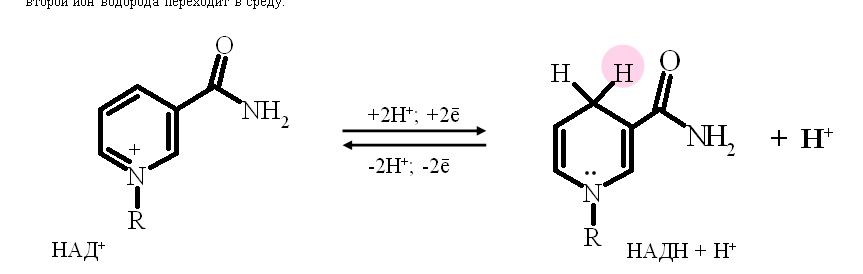
НАД+, присоединяя протоны и электроны от различных субстратов, служит главным коллектором энергии окисляемых веществ и главным источником электронов, обладающих высоким энергетическим потенциалом, для ЦПЭ.
Субстратами, отдающими протоны Н+ и электроны на НАД-зависимые дегидрогеназы, являются: изоцитрат, α-кетоглутарат, малат, ПВК, глутаминовая кислота (глутамат) и др.
НАДФН не является непосредственным донором ЦПЭ, а используется исключительно в восстановительных биосинтезах.
Флавиновые дегидрогеназы содержат в качестве простетических групп ФАД или ФМН. Рабочей частью ФАД и ФМН является витамин В2, к которому присоединяются от окисляемого субстрата два протона Н+ и два электрона
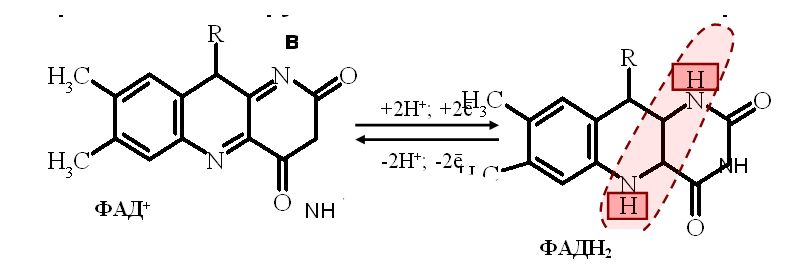 .
Большинство ФАД-зависимых дегидрогеназ
– растворимые белки, локализованные в
матриксе митохондрий. Они являются
акцепторами протонов Н+ и
электронов от субстратов: ацил-КоА,
глицерол-3-фосфат и др.
.
Большинство ФАД-зависимых дегидрогеназ
– растворимые белки, локализованные в
матриксе митохондрий. Они являются
акцепторами протонов Н+ и
электронов от субстратов: ацил-КоА,
глицерол-3-фосфат и др.
Исключение составляет сукцинат-фумарат дегидрогеназа, находящаяся во внутренней мембране митохондрий. Это II комплекс в ЦПЭ. Она является акцептором протонов Н+ и электронов от субстрата – янтарная кислота (сукцинат).
Цитохромы — это гемопротеины — белки, содержащие в качестве прочно связанной простетической группы гем. Атом железа в геме может менять валентность, присоединяя или отдавая электроны. В дыхательной цепи цитохромы служат переносчиками электронов и располагаются соответственно величине окислительно—восстановительного потенциала следующим образом: B, С1, С, а, а3. Гемовые группы цитохромов связаны с белковой частью донорно—акцепторными связями между ионом железа и соответствующими аминокислотными остатками. В цитохромах С и С1 дополнительные ковалентные связи формируются между тиогруппами цистеина и боковыми винильными группами гема. QН2—дегидрогеназа (комплекс III) представляет собой комплекс цитохромов b и С1. Этот фермент катализирует окисление восстановленного кофермента Q и перенос электронов на цитохром С. Электроны последовательно переносятся атомами железа цитохромов b и С1, а затем поступают на цитохром С. Протоны после окисления QH2 освобождаются в раствор.
