
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3.
- •Вопрос 4.
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 11.
- •Вопрос 15.
- •Вопрос 16
- •Вопрос 17
- •Вопрос 18
- •Вопрос 20
- •Вопрос 21
- •Вопрос 22
- •Вопрос 22. Атом водорода. Потенциалы возбуждения и ионизации. Квантовые числа. Вырожденные состояния.
- •Вторая часть билета!
- •Вопрос 23. Ширина спектральных линий. Мультиплетность спектров. Спин электрона. Магнетон Бора.
- •24.Спин орбитальное взаимодействие. Эффект Зеемана. Принцип Паули. Расположение элементов в системе Менделеева.
- •Вопрос 25. Ионная и ковалентная связи атомов в молекуле. Энергия диссоциации. Полная энергия молекулы. Вращательные, колебательно-вращательные полосы.
- •Вопрос 26. Вынужденное излучение. Мазеры. Лазеры. Накачка метастабильных уровней. Свойства лазерного излучения.
- •27. Фазовое пространство. Функция распределения. Понятие о квантовой статистике Бозе-Эйнштейна и Ферми-Дирака.
- •29.Квантовая теория свободных электронов в металле. Уровень Ферми. Запрещенные зоны. Валентная зона. Зона проводимости
- •30.Электропроводность металлов. Сверхпроводимость. Температурные зависимости проводимости.
- •31.Дырочная проводимость. Примесная проводимость. Запрещенные зоны. Валентная зона. Зона проводимости.
- •32.Работа выхода. Термоэлектронная эмиссия. Контактная разность потенциалов.
- •33). Контактные явления в полупроводниках
- •35). Основные свойства атомного ядра.
- •36). Масса и энергия связи. Дефект массы. Деление тяжелых и синтез легких ядер.
- •37.Ядерные силы. Модели ядра. Мезоны.
- •1.Капельная модель ядра.
- •2.Оболочечная модель ядра.
- •38.Радиоактивность. Постоянная распада. Альфа, бета и гамма излучения. Закон радиоактивного распада.
- •39. Альфа-распад. Бета-распад. Правила смещения.
- •40). Реакция деления ядра. Цепная реакция деления.
- •41 Космическое излучение. Типы взаимодействия элементарных частиц. Частицы и античастицы
- •42 Классификация элементарных частиц. Кварки.
Вопрос 22. Атом водорода. Потенциалы возбуждения и ионизации. Квантовые числа. Вырожденные состояния.
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Ze
(11) где r - расстояние между электроном и ядром, получим уравнение Шредингера в виде
(12) где m масса электрона Е- полная энергия электрона в атоме.
(13)
В теории диф уравнений доказывается, что уравнение (12) имеет решение только при дискретных отрицательных значениях энергии (14)
где n = 1, 2, 3,... главные квантовые числа.
Самый нижний уровень Е1 отвечающей минимальной возможной энергии- основной, все остальные- возбужденные. При Е<0 движение электрона является связанным- он находится внутри гиперболической потенциальной ямы. По мере роста главного квантового числа n энергетические уровни располагаются теснее и при n= при E> 0 соответствует ионизированному атому. Энергия ионизация атома водорода равна На освобождение электрона от связи с атомным ядром, вследствие чего и происходит образование положительного иона, необходимо затратить определенное количество энергии. Энергия, израсходованная на отрыв электрона, называется работой ионизации. Количество энергии, выраженное в электронвольтах, которое необходимо затратить для возбуждения атома или молекулы газа, называется потенциалом возбуждения. Возбужденное состояние атома или молекулы газа является неустойчивым, и электрон может снова возвратиться на стационарную орбиту, а атом или молекула перейдет в нормальное невозбужденное состояние. Энергия возбуждения при этом передается в окружающее пространство в форме светового электромагнитного излучения.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .) Момент импульса электрона квантируется
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. В квантовом состоянии с заданным значением орбитального квантового числа , магнитное квантовое число может принимать различных значений из ряда.
Вторая часть билета!
Вопрос 23. Ширина спектральных линий. Мультиплетность спектров. Спин электрона. Магнетон Бора.
Мультиплетность спектров: Структура спектра, отражающая расщепление линий на компоненты, называется тонкой структурой. Сложные линии, состоящие из нескольких компонент, получили название мультиплетов. Тонкая структура обнаруживается, кроме щелочных металлов, также и у других элементов, причем число компонент в мультиплете может быть равно 2м, 3м, 4м, 5 ти и тд. В частном случае спектральные линии могут быть одиночными.
Расщепление спектральных линий, обусловлено расщеплением энергетических уровней. Для объяснения расщепления уровней Гаудсмит и Уленбек выдвинули гипотезу о том, что Электрон обладает собственным неуничтожимым механическим моментом импульса, не связанным с движением электрона в пространстве,- спином.
Согласно общим выводам квантовой механики, спин квантуется по закону:
Ls=h![]() ,
где s
– спиновое квантовое число.
,
где s
– спиновое квантовое число.
Спин электрона- это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Если электрону
приписывается собственный механический
момент импульса(спин) Ls,
то ему соответствует собственный
магнитный момент Рms
и направленный в противоположную
сторону: Рms=
![]() Величина
Величина ![]() .
называется гидромагнитным отношением
спиновых моментов. Прекция собственного
магнитного момента на направление
вектора В может принимать только одно
из следующих 2х значений:
.
называется гидромагнитным отношением
спиновых моментов. Прекция собственного
магнитного момента на направление
вектора В может принимать только одно
из следующих 2х значений: ![]() , где h=
h/
(2
, где h=
h/
(2![]() (h-
постоянная Планка),
(h-
постоянная Планка), ![]() -
магнетон
Бора,
являющийся единицей магнитного момента
электрона.
-
магнетон
Бора,
являющийся единицей магнитного момента
электрона.
Ширина спектральных
линий, интервал
частот v (или
длин волн l = c/n, с
— скорость
света), характеризующий спектральные
линии в спектрах
оптических атомов,
молекул и др. квантовых систем. Каждому
излучательному квантовому
переходу между
дискретными уровнями энергии Ek и Eiсоответствует
некоторый интервал Dnki частот,
близких к частоте перехода ![]() (
(![]() — Планка
постоянная).
Значение Dnki определяет
Ш. с. л. ¾ степень
немонохроматичности данной спектральной
линии. Контур спектральной линии j(n)
[зависимость интенсивности испускания
(поглощения) от частоты] обычно имеет
максимум при частоте перехода nki или
вблизи неё (см. рис.);
за Ш. с. л. принимают разность частот,
которым соответствует уменьшение
интенсивности вдвое (её называют иногда
полушириной спектральной линии). Если
не учитывать Доплера
эффект,
Ш. с. л. Dnki определяется
суммой ширин
уровней энергии Ek и Ei
— Планка
постоянная).
Значение Dnki определяет
Ш. с. л. ¾ степень
немонохроматичности данной спектральной
линии. Контур спектральной линии j(n)
[зависимость интенсивности испускания
(поглощения) от частоты] обычно имеет
максимум при частоте перехода nki или
вблизи неё (см. рис.);
за Ш. с. л. принимают разность частот,
которым соответствует уменьшение
интенсивности вдвое (её называют иногда
полушириной спектральной линии). Если
не учитывать Доплера
эффект,
Ш. с. л. Dnki определяется
суммой ширин
уровней энергии Ek и Ei 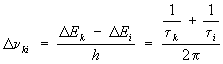 ,
т. е. Dnki тем
больше, чем меньше времена жизни tk и ti.
Радиационная (естественная) Ш. с.
л. соответственно
равна: (Dnki) рад = (Ak + Ai)/2p(где Ak и Ai— полные
вероятности спонтанных переходов с
уровней Ek и Ei на
все нижележащие уровни); она очень мала
и обычно Ш. с. л. для атомов и молекул
определяется в основном уширением их
уровней энергии при взаимодействии с
окружающими частицами (в газе и плазме
— при столкновениях), а также уширением
спектральных линий вследствие эффекта
Доплера. В зависимости от типа уширения
получается симметричный или асимметричный
контур спектральных линий (на рис.
показан симметричный, т. н. дисперсионный,
контур, характерный для радиационного
уширения).
,
т. е. Dnki тем
больше, чем меньше времена жизни tk и ti.
Радиационная (естественная) Ш. с.
л. соответственно
равна: (Dnki) рад = (Ak + Ai)/2p(где Ak и Ai— полные
вероятности спонтанных переходов с
уровней Ek и Ei на
все нижележащие уровни); она очень мала
и обычно Ш. с. л. для атомов и молекул
определяется в основном уширением их
уровней энергии при взаимодействии с
окружающими частицами (в газе и плазме
— при столкновениях), а также уширением
спектральных линий вследствие эффекта
Доплера. В зависимости от типа уширения
получается симметричный или асимметричный
контур спектральных линий (на рис.
показан симметричный, т. н. дисперсионный,
контур, характерный для радиационного
уширения).
