
- •Розділ 1. Основні поняття і визначення.
- •Розділ 2. І закон термодинаміки.
- •I закон термодинаміки:
- •Розділ 3. Теплоємність ідеальних газів
- •Розділ 4. Термодинамічні процеси.
- •Розділ 5. Іі закон термодинаміки
- •Для оборотного циклу Карно ∑ приведених теплот завжди дорівнює 0.
- •II закон термодинаміки має статистичний, обмежений по застосуванню характер, тобто він не дотримується в мікросистемах і в умовах глибокого вакууму.
Розділ 5. Іі закон термодинаміки
Розділ 5.1. Коловий процес.
В процесі розширення 1а2
здійснюється робота:
процесі розширення 1а2
здійснюється робота:
![]() .
.
Робоче
тіло повертається в початковий стан
процесом стиснення 2b1
на здійснення якої витрачається
![]() .
.
Корисна
робота в циклі:
![]() .
.
Корисне
тепло:
![]() .
.
Для кругового процесу: 1а2b1.
![]() ,
,
![]()
![]() -
завжди в циклі.
-
завжди в циклі.
![]()
Все корисне тепло йде на здійснення корисної роботи.
Круговим процесом або циклом називається сукупність 2-х або декількох процесів, що повертають робоче тіло в початковий стан.
Ступінь термодинамічної досконалості циклу або його термічне ККД визначається як відношення корисної теплоти до витраченої:
![]()
Цикли бувають прямими і зворотними; оборотними і необоротними.
Прямими
називаються цикли, в яких процеси
протікають за годинниковою стрілкою.
Причому процеси розширення розташовуються
над процесами стиснення, і
![]() ,
здійснюється за рахунок теплоти, що
підводиться.
,
здійснюється за рахунок теплоти, що
підводиться.
По цих циклах працюють всі теплові двигуни.
![]()

Зворотними
називаються цикли, в яких процеси йдуть
проти годинникової стрілки і процеси
розширення розташовуються під процесами
стиснення,
![]() ,
здійснюється зовнішнім приводним
двигуном.
,
здійснюється зовнішнім приводним
двигуном.
По цих циклах працюють холодильні установки і теплові насоси.
Оборотними називаються цикли, що складаються з оборотних процесів.
Безповоротність одного процесу в циклі робить цикл повністю необоротним.
Розділ 5.2. Загальні властивості циклів.
I. Властивість оборотного циклу Карно:
![]() ,
,
![]()
![]()
знак “–”, оскільки q2 - тепло, що відводиться.
![]()
![]()
![]() -
приведена теплота.
-
приведена теплота.
Для оборотного циклу Карно ∑ приведених теплот завжди дорівнює 0.
II. Властивість довільного оборотного циклу:
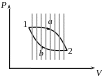
Досліджуваний цикл 1a2b1 розбиваємо еквідистантними адіабатами на частини, обмеживши частини ізотермами. Отримуємо n-у кількість циклів, вписаних в досліджуваний цикл.
Для кожного циклу Карно , тоді для циклу, обмеженого ламаною:
![]()
Для
циклу 1a2b1
![]() - для будь-якого оборотного циклу
- для будь-якого оборотного циклу
![]() від
приведених
теплот
рівний
0.
від
приведених
теплот
рівний
0.
ІІІ. Властивість необоротного циклу Карно:
Із-за
тертя і втрат
![]() термічного оборотного циклу >
термічного необоротного.
термічного оборотного циклу >
термічного необоротного.
![]()
![]() ,
,
![]()
![]() ,
,
![]() ,
,
![]()
Для необоротного циклу Карно ∑ приведених теплот завжди величина від’ємна.
ІV. Властивості довільного необоротного циклу:
Ґрунтуючись на виведенні властивості довільного оборотного циклу і враховуючи властивості необоротного циклу Карно, отримаємо для будь-якого необоротного циклу:
![]()
Для будь-якого необоротного циклу від приведених теплот - величина від’ємна.
Розділ 5.3. Цикл Карно.
Цикл Карно є ідеальним циклом теплових двигунів.

Цикл Карно складається з двох ізотерм AB і CD, і двох адіабат BC і DA.
(dq=0)
У
ізотермічному процесі AB
при
підводі теплоти q1
температура
![]() ,
у точці B
припиняється нагрів робочого тіла, але
його розширення продовжується
адіабатним
процесом BC,
при здійсненні якого зменшується ΔU,
отже, зменшується температура до T2.
,
у точці B
припиняється нагрів робочого тіла, але
його розширення продовжується
адіабатним
процесом BC,
при здійсненні якого зменшується ΔU,
отже, зменшується температура до T2.
У ізотермічному процесі CD робоче тіло охолоджується при відведенні теплоти q2, а температура = T2. Цикл замикається адіабатним процесом стиснення DA, де температура росте від T2 до T1.
![]()
![]() ;
BC:
;
BC:
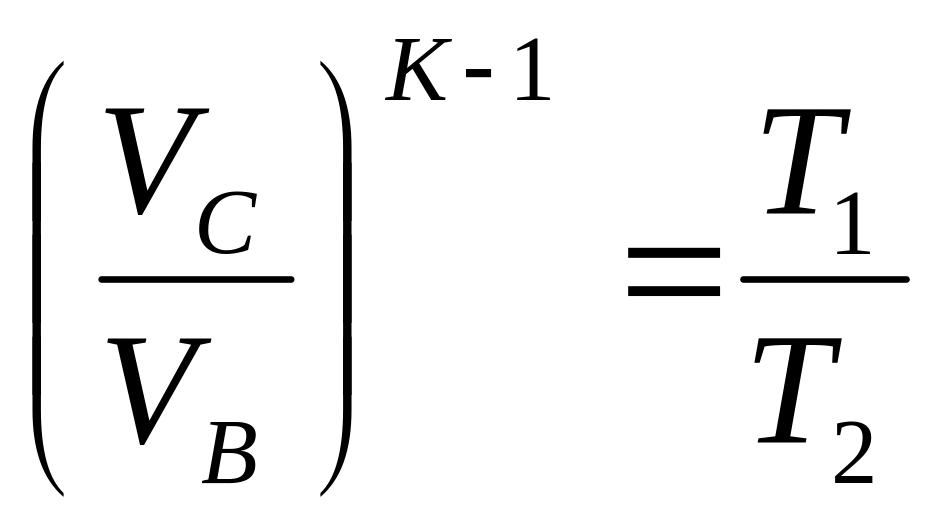
![]() ;
DA:
;
DA:

![]() ,
,
![]() ,
,
![]()

Властивості термічного ККД циклу Карно
1)
![]() ,
,
![]()
2)
![]() ,
,
![]() ,
,
![]() ,
,
![]()
3)
![]() не
залежить від природи робочого тіла.
не
залежить від природи робочого тіла.
4)
для збільшення
необхідно підвищувати
![]() і зменшувати
і зменшувати
![]() .
.
Розділ 5.4. Ентропія, змінення ентропії при необоротних процесах.
Зміна ентропії в оборотному процесі:
З
математики відомо, що якщо![]() ,
то підінтегральній вираз є повний
диференціал функції. Позначимо функцію
S
-
ентропія.
,
то підінтегральній вираз є повний
диференціал функції. Позначимо функцію
S
-
ентропія.
![]() ,
,
![]()
Зміна ентропії в необоротних процесах:
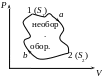
У цьому циклі процес 1a2 необоротний, отже цикл також необоротний і для нього.
![]()
Для
оборотного процесу 2b1:
![]()
![]() ,
,
![]() ,
,
![]()
Для
будь-якого процесу
![]() ,
,
знак “=”: оборотні процеси
знак “>”: необоротні процеси
- інтеграл Клазіуса
Ентропія є параметром, що визначає стан робочого тіла. Як і всі параметри, вона не залежить від характеру процесу.
1
кг:
S,
![]()
m
кг:
![]() ,
,
![]()
Ентропія “умовної” ізольованої системи:
Якщо між тілами або групами тіл в якийсь момент протікають найбільш інтенсивні теплові процеси, то їх можна вважати “умовно” ізольованими від інших тіл.
Якщо
в системі протікають оборотні процеси,
то
![]() ;
;
![]() ,
,
![]()
В цьому випадку ентропія не змінюється.
Якщо в системі протікають необоротні процеси, то ;
![]()
Тобто в реальних процесах ентропія може тільки зростати.
Ентропія вводиться для визначення напряму і тривалості протікання реальних процесів.
Енергія є першоосновою існування Всесвіту і всього, що в ньому є. Тобто енергія - джерело всіх живих сил у всесвіті.
Ентропію можна назвати тінню енергії, оскільки в будь-якій системі, якщо відбуваються якісь зміни енергії, обов'язково змінюється і ентропія. Вона прагне зменшити, а іноді і знищити все те, що створене енергією.
Якщо кількість енергії постійна, то кількість ентропії весь час збільшується. При цьому відбувається деградація енергії, зменшується її цінність.
Поняття “енергії” раніше не було відоме вченим, але в дослідженнях вони використовували те, що ми зараз включаємо в поняття енергії, не вникаючи в суть цього поняття і не знаючи його властивостей.
Вперше термін “енергія” в 1807 році використав англійський учений Юнг і застосував до живої сили.
А в 1829 році він уточнив поняття “Живої сили”.
![]()
m - маса, W - швидкість
Визначення поняття енергії стало можливим після обґрунтування закону збереження енергії.
Вперше чітке визначення поняття енергії дав англійський учений лорд Кельвін.
“Енергія матеріальної системи в якому-небудь стані являє собою зміряну в одиницях роботи суму всіх дій, які проводяться поза системою під час переходу її з первинного стану в довільно вибраний за “0” стан”.
Енгельс дав наступне формулювання: “Енергія - це міра різних форм руху матерії”.
Поняття ентропії було введене в 1865 році німецьким вченим Клаузіусом.
Ентропія: “ен” - “в”, “тропос” - ”зміна”.
При виборі назви Клаузіус орієнтувався на назву “енергія”, оскільки обидва ці поняття мають багато загального у фізичному сенсі.
Ентропія і енергія є фізичними станами робочого тіла, а тепло, в якому перетворюється енергія, є функцією процесу.
Больцман встановив залежність між S і вірогідністю термодинамічної системи. Стан термодинамічної системи може бути заданий з одного боку макроскопічними величинами (P і T), з іншого боку - цей же стан може бути заданий цілим рядом мікро величин, тобто розподілом молекул за швидкостями і енергіями.
При мимовільному переході робочого тіла в інший стан до вірогідного розподілу молекул за швидкостями і енергіями додаються нові стани розподілу, тобто вірогідність системи зростає і S збільшується.
На
підставі виразу
![]() видно, що при збільшенні вірогідності
системи P
зростає
і S.
видно, що при збільшенні вірогідності
системи P
зростає
і S.
Тобто S є мірою вірогідного стану термодинамічної системи і збільшується при переході від менш вірогідного стану до більш вірогідного.
Ентропію використовують для визначення безладу в будь-якій системі.
Безлад найбільш вірогідний, ніж порядок. Тому за початок відліку ентропії будь-якої системи можна прийняти стан max безладу цієї системи.
Із збільшенням порядку в системі S зменшується, тому при охолодженні газу і перетворенні його в рідину наступає великий порядок, а при перетворенні рідини на тверде тіло в процесі охолоджування ще більший порядок. Це дозволило німецькому фізикові-хімікові Нернсту прийти до висновку, що при наближенні температури до абсолютного “0”, ентропія тіла також прагне до “0”.
Розрізняють S теплову, структурну і інформаційну.
Структурна S є мірою невпорядкування будови системи.
Завдання інформації - відповідати на питання: “що?”, ”де?”, ”коли?”.
Будь-яка система може бути охарактеризована нескінченною кількістю властивостей. Отже, інформація про неї буде нескінченно велика, але цінність інформації полягає не в її кількості, а в можливості використання її в конкретних цілях.
Нескінченна кількість інформації створює труднощі для її переробки і передачі. В даний час існує лише формальна математична теорія передачі інформації. В основі інформації лежить енерго-ентропійная теорія, оскільки S є мірою недостачі інформації.
З іншого боку існує зв'язок між S і кібернетикою (наука про управління та зв'язок), а управління - сукупність процесів збору, обробки, перетворення і передачі інформації для здійснення цілеспрямованих дій.
Будь-яка система, що здійснює ці процеси, називається кібернетичною машиною. У початковому стані машина повна невизначеності і її S велика, в міру L машини і надходження в неї інформації, S зменшується; і якщо S при роботі машини залишається незмінною або починає зростати, це свідчить про деградацію машини.
Реакційна суть теорії “теплової смерті” Всесвіту |
Німецький
вчений Клаузіус, ввівши поняття
“ентропії” в другій половині 19
сторіччя, ґрунтуючись на принципі
зростання ентропії в необоротних
процесах
|
Розділ 5.5. Математичний вираз ІІ закону термодинаміки.
Формулювання II закону термодинаміки
Тепло від тіла менш нагрітого не може бути передано тілу більш нагрітому само собою без здійснення роботи.
Не все тепло, що підводиться в циклі, йде на здійснення корисної роботи, частина теплоти відводиться, знецінюючись в циклі.
Для здійснення циклу теплового двигуна необхідно мати два теплоджерела з різними температурами.
Не можна здійснити вічний двигун другого роду.
