
Розділ 6. Ексергія.
Розділ 6.1. Ефективність перетворення енергії різних видів.
Метод оцінки теплових двигунів за допомогою ККД
Існуючий метод оцінки енергоперетворюючих установок за допомогою ККД не завжди є перспективним, тобто відображає реальні умови перетворення різних форм енергії і неперспективність цих процесів. Більшість вживаних ККД засновані на кількісній оцінці перетворення енергії, тобто на I законі термодинаміки.
![]() будь-якого
теплового двигуна оцінює тільки зовнішні
умови його роботи і не враховує ступінь
безповоротності процесів, що протікають
в двигуні. Для аналізу роботи внутрішніх
частин установок вводиться цілий ряд
додаткових ККД:
будь-якого
теплового двигуна оцінює тільки зовнішні
умови його роботи і не враховує ступінь
безповоротності процесів, що протікають
в двигуні. Для аналізу роботи внутрішніх
частин установок вводиться цілий ряд
додаткових ККД:
механічний
ККД:
![]()
електричний
ККД:
![]()
відносно
ефективний ККД:
![]()
тепловий
внутрішній ККД:
![]()
В
більшості випадків ці
![]() не можна зв'язати в єдину систему, що
ускладнює аналіз роботи двигуна. Окрім
того ККД не враховують якість
використовуваної і отримуваної енергії,
цінність якої визначається видом енергії
і параметрами робочого тіла.
не можна зв'язати в єдину систему, що
ускладнює аналіз роботи двигуна. Окрім
того ККД не враховують якість
використовуваної і отримуваної енергії,
цінність якої визначається видом енергії
і параметрами робочого тіла.
Метод ККД не враховує ступінь безповоротності процесів в енергоперетворюючих установках.
Працездатність системи. Втрата працездатності
Будь-яка ізольована система здатна зробити L тільки в тому випадку, якщо вона знаходиться в механічному або термічному нерівноважному стані з навколишнім середовищем.
Якщо робоче тіло в ізольованій системі має тиск вище, ніж тиск навколишнього середовища, то система знаходиться в механічно нерівноважному стані і l може бути отримана за рахунок розширення робочого тіла. Якщо робочі тіла, що входять в ізольовану систему, мають неоднакові температури, але однаковий з навколишнім середовищем тиск, то система знаходиться в термічному нерівноважному стані. В цьому випадку тепло може передаватися від робочого тіла з більшою температурою до робочого тіла з меншою температурою і до навколишнього середовища без здійснення роботи - йде теплообмін між тілами.
В процесі здійснення l або теплообміну система все ближче підходить до стану рівноваги. Максимальна робота може бути отримана, якщо в системі протікають оборотні процеси і зокрема адіабатний і ізотермічний.
Важливо знати яку корисну і max корисну роботу може дати нам та або інша система в тому або іншому стані.
Розглянемо
термодинамічну систему, що складається
з робочого тіла і навколишнього
середовища. Причому параметри робочого
тіла
![]() ,
,
![]() не рівні параметрам навколишнього
середовища (
не рівні параметрам навколишнього
середовища (![]() ,
,![]() вважаємо
незмінними в процесі здійснення роботи
в системі).
вважаємо
незмінними в процесі здійснення роботи
в системі).
![]() -
початкове значення внутрішньої енергії
системи
-
початкове значення внутрішньої енергії
системи
![]() - кінцеве
значення
- кінцеве
значення
![]() ;
;
![]() -
навколишнє середовище
-
навколишнє середовище
![]() ;
;
![]() - робоче тіло
- робоче тіло
Оскільки внутрішня енергія володіє властивостями адиктивності, то:
![]()
![]()
В ізольованій системі l здійснюється за рахунок зміни внутрішній енергії:
![]()
Замінимо:
![]()
![]()
Усередині
системи робоче тіло може віддавати
тепло навколишньому середовищу
![]() і може здійснюватися l
по
витісненню робочого тіла в навколишнє
середовище (-l).
і може здійснюватися l
по
витісненню робочого тіла в навколишнє
середовище (-l).
По I закону термодинаміки:
![]() ,
,
![]() ,
,
![]()
![]()
![]()
![]() ,
,
![]()
![]() ,
,
![]() ,
,
![]()
![]() -
необоротний процес
-
необоротний процес
Ця формула є корисною роботою, отриманою в системі, тобто саме тою, яку можна використовувати надалі, оскільки із загальної кількості роботи вже відняли роботу, витрачену на видалення відпрацьованого робочого тіла, яке ми використовувати не можемо.
Ця формула використовується в тому випадку, якщо в системі протікають необоротні процеси, при здійсненні яких ентропія зростає.
![]()
Для
того, щоб використовувати отриманий
вираз для визначення роботи у разі
протікання в системі оборотних процесів,
треба врахувати, що в ізольованій системі
![]() ,
тобто зменшення S
робочого
тіла рівне збільшенню S
навколишнього
середовища.
,
тобто зменшення S
робочого
тіла рівне збільшенню S
навколишнього
середовища.
![]()
![]() -
оборотний процес.
-
оборотний процес.
У даному
виразі
![]() є роботою адіабатного
процесу,
а
є роботою адіабатного
процесу,
а
![]() - роботою ізотермічного процесу.
- роботою ізотермічного процесу.
Втрату
роботи (працездатності системи) унаслідок
того, що дійсні процеси необоротні
отримаємо, віднімаючи
![]() ;
;
![]()
![]()
![]()
Дозволяє оцінити втрату працездатності системи унаслідок безповоротності процесів, що протікають в ній.
А безповоротність пропорційна зростанню ентропії.
Найбільше практичне застосування має працездатність джерела теплоти:
![]()
![]()
![]() - що
підводиться
- що
підводиться
![]()
З виразу
видно, що чим менше відношення
![]() ,
тобто чим вище температура джерела
теплоти
,
тобто чим вище температура джерела
теплоти
![]() ,
тим більшу l
можемо
отримати за рахунок теплоти
.
Під працездатністю джерела теплоти
розуміють ту роботу, яку можна отримати
в тепловому двигуні, підводячи тепло
до досягнення рівноваги з навколишнім
середовищем.
,
тим більшу l
можемо
отримати за рахунок теплоти
.
Під працездатністю джерела теплоти
розуміють ту роботу, яку можна отримати
в тепловому двигуні, підводячи тепло
до досягнення рівноваги з навколишнім
середовищем.
![]()
![]()
![]()
![]()
![]() отримують
по досягненню рівноваги між робочим
тілом і навколишнім середовищем, і тоді
кінцеві параметри робочого тіла рівні
параметрам навколишнього середовища.
отримують
по досягненню рівноваги між робочим
тілом і навколишнім середовищем, і тоді
кінцеві параметри робочого тіла рівні
параметрам навколишнього середовища.
![]() ,
,
![]()
![]()
Розділ 6.2. Ексергія і енергія.
Науковий підхід до аналізу всіх енергетичних перетворень в промисловості, сільському господарстві і побуті необхідний для проведення енергозберігаючої політики. Цей аналіз повинен починатися з первинних енергетичних ресурсів і закінчуватися використанням вторинних енергетичних ресурсів і відходів виробництва з урахуванням їх екологічної дії. Базою такого аналізу є технічна термодинаміка.
З метою розробки компактного і наочного методу оцінки енергоперетворень, починаючи з 60-х років нашого сторіччя в термодинаміці виділився в самостійний розділ метод, що отримав назву ексергетичний.
Ексергія є придатністю енергії до подальшого використання в будь-яких конкретних умовах.
Ексергетичний метод дозволив знайти і виявити зв'язок термодинамічних характеристик об'єктів з їх економічними, а в даний час і екологічними. І на підставі цих зв'язків розроблений метод, що дозволяє в кожній конкретній установці або в її вузлах знайти (оцінити) втрати працездатності системи, тобто втрати ексергії. На основі цього розробити низку конкретних заходів, що знижують ці втрати.
На виробництві поняття “ексергії” практично не використовується. Причиною цього є недостатня інформованість інженерних працівників і те, що до останнього часу методики, що дозволяють використовувати цей метод на практиці, не були доведені до завершального етапу. Відсутність ексергетичного мислення у практиків гальмує рух до скорочення енергоємності і матеріаломісткості вироблюваної продукції.
Ексергія введена в 1956 році вченим Рантом. Коли Рант вводив визначення:
e (грецьке слово) → “эр” - ”робота”, “екс” - ”із, ззовні”
Ексергія є вужчим поняттям в порівнянні з енергією, вона відображає тільки превратимість енергії з метою подальшого використання.
Порівняння властивостей енергії і ексергії
Енергія |
Ексергія |
|
|
|
|
|
|
|
|
I закон термодинаміки дав можливість оцінити тільки кількісну сторону енергоперетворень, а ексергетичний метод, що використовує I і II закони термодинаміки дав можливість оцінити кількісну і якісну сторону енергоперетворень.
Всі види енергії по ступеню і превратимості в інші ділять на:
1) повністю превратимі (механічна робота за винятком роботи виштовхування, електрична енергія, ядерна енергія);
2) частково превратимі (внутрішня енергія робочого тіла і теплота);
3) непревратимі (внутрішня енергія навколишнього середовища).
Повністю превратимі види енергії - це ексергия.
“Використання”, “споживання”, “передача”, - ці терміни не застосовні до розуміння енергії і повністю виправдані для поняття ексергія.
Найчастіше використовують поняття “Ексергія робочого тіла” (за наявності носія ексергії) і “ексергія теплоти”.
e -
1 кг,
![]()
E - m кг, Дж
![]() ,
,
![]() ,
(без
індексу: e
- звичайне
тіло)
,
(без
індексу: e
- звичайне
тіло)
![]()
![]()
![]() - втрата
e,
обумовлена безповоротністю процесу -
анергія.
- втрата
e,
обумовлена безповоротністю процесу -
анергія.
![]() - не
може бути перетворена на інші види і є
втратою e
або
та частина енергії, яка не за яких умов
не може бути корисно використана.
- не
може бути перетворена на інші види і є
втратою e
або
та частина енергії, яка не за яких умов
не може бути корисно використана.
Енергія = Ексергія + Анергія
Енергія є сумою превратимої частини (e) і непревратимої ні за яких обставин - анергії. Кожен з доданків правої частини може приймати значення рівне 0 за конкретних умов, наприклад:
Якщо використовується електрична енергія, то анергія рівна 0.
Внутрішня
енергія і тепло при параметрах
навколишнього середовища мають
![]() .
.
Ексергетичний метод не є універсальним, він не застосовний до тих установок, для яких I і II закон термодинаміки не застосовні. Це чисто механічні установки, електричні і електронні. Основу промисловості складають енергетичні технологічні установки, призначені для перетворення потоку енергії і речовини.
Потік енергії перетвориться в установках на теплових електростанціях, тепломасозмінних установках, в теплонасосах, холодильних, криогенних установках...
Цей величезний круг питань може вирішуватися за допомогою e, оскільки незалежно від виду виробництва в них працюють одні і ті ж блоки і установки, в яких протікають однакові процеси: теплообмінники, печі, реактори, установки змішувачів і тому подібне.
Розділ 6.3. Ексергетичний баланс.

![]() необоротний
(>), оборотний (=)
необоротний
(>), оборотний (=)
Будь-яку термодинамічну систему (установку або її вузли) можна представити на схемах у вигляді прямокутних контурів, які називаються термодинамічними ящиками.
Ефективність роботи можна оцінити абсолютними і відносними ексергетичними величинами.
Наприклад, ексергетичний ККД:
![]()
Дуже зручно і наочно можна представити ексергію.
Баланс будь-якої установки графічно у вигляді ексергетичної діаграми.
На вході потік E прийнятий за 100%, а на виході за винятком втрат на різних частини установки.

Розділ 7. Диференціальні рівняння термодинаміки
Розділ 7.1.Умови рівноваги термодинамічної системи.
Розділ 7.2.Рівняння Максвела.
Розділ 7.3.Диференціальне рівняння стану термодинамічної системи.
Розділ 7.4.Диференціальне рівняння внутрішньої енергії, ентальпії і ентропії.
Розділ 7.5.Термодинамічні потенціали.
Розділ 7.6.Рівняння Клапейрона-Клаузіуса.
Розділ 8. Термодинаміка реальних тіл.
Розділ 8.1. Основні особливості реальних тіл.
В ідеальних газах силами взаємодії між молекулами і їхніми власними об’ємами нехтують. За певних умов ці допущення цілком задовольняють вимоги практичних задач, але за високих тисків властивості реальних газів значно відрізняються від ідеальних і їх неможливо описати за допомогою рівняння стану ідеальних газів. Чим більша густина газів, тим більші відхилення. Це свідчить про те, що в таких випадках слід враховувати власний об’єм і сили взаємодії між молекулами, які можуть спричинити асоціацію або дисоціацію молекул, що суттєво впливає на властивості газів.
Наявність власного об’єму має привести до зменшення стиснення реального газу порівняно з ідеальним, оскільки зменшується вільний об’єм між молекулами. Але наявність сил міжмолекулярного притягання і відштовхування значно ускладнюють поведінку реальних газів.
Розділ 8.2. Рівняння стану реальних газів.
З цілого переліку запропонованих рівнянь стану реального газу найясніше відображає фізичний сенс цих газів рівняння Ван-дер-Ваальса:
![]()
![]() -
величина, що враховує сили зчеплення
між молекулами, які знаходяться в
зворотній залежності від питомого
об'єму.
-
величина, що враховує сили зчеплення
між молекулами, які знаходяться в
зворотній залежності від питомого
об'єму.
Сили зчеплення прагнуть утримати молекули на певній відстані, і в цьому випадку кількість ударів молекул об стінки посудини збільшується, тому сили зчеплення плюсуються до абсолютного P.
b - характеризує об'єм молекул і об'єм сфер, які утворюються навколо кожної молекули.
Реальна зміна об'єму V зменшується на величину b.
Розділ 8.3. Процеси утворення водяної пари.
Водяна пара близька до стану насичення.
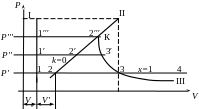
Стан водяної пари в Р-V координатах починається з т.1. Нагріваємо воду в закритому просторі до кипіння, а Т і V збільшується; Р = const. Процес нагрівання води до кипіння - 1-2. При нагріванні киплячої води з неї, долаючи сили поверхневого натягнення, вилітають молекули що мають значно більший V. Під Р цих молекул поршень піднімається утворюючи простір між ними.
Н2О - ті ж молекули пари, але що значно більшу швидкість руху. У міру нагрівання киплячої води, все більше число молекул пари вилітають в паровий простір з води, але разом з тим частина молекул пари, що втратила V, за рахунок зіткнення один з одним, повертаються в загальну масу води (конденсуються). У якийсь Δt в паровому просторі знаходитиметься max можлива кількість молекул пари. Така пара називається насиченою.
При повному випаровуванні води отримують суху насичену пару. Якщо ж в цій парі крапельки води в повітряному стані, то пара – волога насичена.
Ваговий зміст сухої пари в 1 т. насиченого називається степенем сухості (Х). Для води Х=0. Для сухого насиченого Х=1. Процес паротворення йде при Р і Т = const з підведенням Q. Процес конденсації також Р і Т = const, але з відведенням Q. При нагріванні сухої насиченої пари Р = const, Т підвищується і отримуємо перегріту пару (3-4).
Розглянемо процес паротворення при 1Р′ > Р. При цьому т.1 піднімається по відношенню до осі V на ΔP. Залишаючись на відстані V 0 від Р. При збільшенні Р, V зменшується і 3′ переміститься лівіше 3.
Лінія ІІ - це нижня гранична крива.
Лінія ІІІ розділяє область насиченої пари і перегрітої пари - це верхня гранична крива.
При подальшому збільшенні Р лінії ІІ і ІІІ зійдуться в т. К Ця точка називається критичною.
Властивості речовини при параметрах К
Немає різниці між агрегатним станом води і пари.
Вода переходить в пару без підведення Q, і пара переходить у воду без відведення Q.
Параметри пари ↑ К називаються надкритичні.
К для води:
Ркр = 225 бар = 22,5 МПа
tкр = 374ºС
Vкр = 0,03 м3/кг
Розділ 8.4. Т-S i I-S діаграми водяної пари.
Т-Ѕ діаграми водяної пари
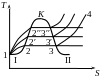
Розглянемо термодинамічні процеси в Т-S координатах.
I. Адіабатний процес:

![]() ,
,
![]()
Інакше цей процес називається ізоентропійним.
II. Ізотермічний процес:
![]()

,
![]()
![]()
![]()
III. Ізохорний процес:

![]() ,
,
![]()
,
![]()
![]() ,
,
![]()
У T-S діаграмі ізохорний процес зображається логарифмічною прямою.
IV. Ізобарний процес:
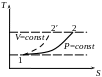
![]() ,
,
![]()
,
![]()
![]() ,
,
![]()
Ізобарний процес в T-S координатах зображається логарифмічною кривою, що йде пологіше ізохори.
V. Політропний процес:
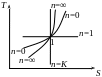
![]()
![]()
З іншого боку:
![]() ,
,
![]()
![]()
VI. Цикл Карно в T-S координатах:


![]()
![]()
![]()
![]()
З графічного зображення циклу Карно в T-S координатах видно, що цей цикл дійсно має в заданому інтервалі температур max значення термічного ККД в порівнянні з ККД будь-якого іншого циклу, здійснюваного в тому ж інтервалі температур, оскільки S прямокутника завжди більш ніж S будь-якої іншої фігури, вписаної в прямокутник.
Розділ 8.5. Термодинамічні процеси водяної пари.
Розділ 9. Суміші газів.
Розділ 9.1. Суміші ідеальних газів. Закон Дальтона.
У більшості теплових двигунів і теплогенеруючих установок робочими тілами є продукти згорання, що є сумішшю газів.
Розглядається механічна суміш, тобто така, в якій хімічні реакції між окремими газами, що називаються компонентами, не протікають.
До кожного компоненту суміші, і до суміші в цілому, застосовне рівняння стану ідеального газу. Компоненти в суміші поводяться незалежно один від одного і P молекул конкретного компоненту на стінки посудини при V і T суміші називають його парціальним тиском.
На основі законів Дальтона:
![]()
![]()
![]()
![]()
Компоненти, що входять в суміш задаються масовими і об'ємними долями. Масові долі компоненту позначаються:
![]() -
відношення маси g
компоненту
до маси сили m.
-
відношення маси g
компоненту
до маси сили m.
![]() ;
;
![]() ;
;
![]()
![]()
![]()
Об'ємні долі:
![]()
Vi - приведений або парціальний об'єм компоненту, що є об'ємом довільного компоненту при тиску і температурі суміші.
![]() - на
основі закону Бойля-Маріотта.
- на
основі закону Бойля-Маріотта.
![]()
![]() ;
;
![]() ;
;
![]()
![]()
![]() ;
;
![]() ;
;
![]()
![]()
![]()
![]()
Взаємозв'язок між масовими і об'ємними долями:
;
![]() ;
;
![]()
![]()
![]()
![]()
![]()
Розділ 9.2. Газова стала та уявна молекулярна маса суміші.
Для визначення газової сталої суміші записується рівняння стану для всіх компонентів від 1-го до n-го при V і T суміші.
![]() ;
;
![]() ;
;
![]()
![]()
Однак для суміші справедливе рівняння . В результаті порівняння цих рівнянь:
![]()
![]()
![]()
![]()
![]() ,
,
![]()
μ - молекулярна маса суміші.
Оскільки молекули суміші немає, то йдеться про „умовну” молекулярну масу, якою вважається молекулярна маса такого однорідного газу, у якого в об'ємі суміші при різній температурі суміші міститься теж число молекул.
![]()
![]()
![]()
Розділ 9.3. Теплоємність газових сумішей.
На практиці доводиться розраховувати теплові установки, де використовуються газові суміші. В довідковій літературі не наводяться дані про теплоємності сумішей. Теплоємність суміші є адитивною величиною і може бути обчислена, якщо відомий склад суміші.
![]() - масова
теплоємність суміші.
- масова
теплоємність суміші.
![]() - об'ємна
теплоємність суміші.
- об'ємна
теплоємність суміші.
Розділ 9.4. Парогазові суміші.
Вологе повітря - це суміш водяної пари і сухого повітря.
Залежно від кількості водяної пари та її стану, вологе повітрі поводить себе як ідеальний або реальний газ.
Вологе повітря розглядається при тиску навколишнього середовища, тому можна його вважати ідеальним газом, тоді тиск вологого повітря Рn збільшуватиметься і граничним можливим значенням Рn є тиск пониження водяної пари при t повітря.
Рп = Рн
Якщо Рп
![]() Рн,
то вологе повітря називається ненасиченим
Рн,
то вологе повітря називається ненасиченим
Якщо Рп = Рн, то повітря називається насиченим, пара знаходиться в стані насичення.
Температура при якій починається конденсація вологи називається точкою роси.
Розділ 9.5. Параметри стану вологого повітря.
Для характеристики поглинальної здатності вологого повітря вводяться такі параметри стану.
Вміст вологи (вологовміст) визначається ваговим змістом пари, в 1 кг сухого повітря, позначається [d].
![]()
mn - маса пари
mв - маса сухого повітря
Абсолютна вологість являє собою масову кількість пари в 1 м3 повітря.
Це густина пари.
![]() ;
;
![]()
![]() ;
;
![]()
![]()
![]()
![]()
![]()
Відносна вологість представляє собою відносну абсолютну вологість пари при t до абсолютної вологості у стані насиченості.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Інакше d можна визначити:
![]()
![]()
![]()
![]()
![]()
![]()
2500 - теплота пароутворення
Розділ 9.6. І-d – діаграма вологого повітря.
Розрахунок теплового обладнання, що використовує вологе повітря, вимагає глибоких професійних навичок. Для полегшення цієї роботи Л.К. Рамзін у 1918 р. запропонував діаграму вологого повітря у І-d координатах. Діаграма побудована для середньорічного атмосферного тиску Р=745 мм.рт.ст.
З достатньою точністю її можна використовувати і за деяких відхиленнях від цього тиску. В 1923 р. Р.Мольє запропонував аналогічну діаграму, і на Заході вона називається його ім’ям.
Для більш раціонального використання площі діаграми осі координат розміщено під кутом 1350. при такому розміщенні координат область ненасиченого стану повітря займає найбільшу площу. Ізоентальпії І=const напрямлені під кутом 450 до горизонту. У зв’язку з тим, що частина діаграми розміщена нижче горизонтальної лінії, проведеної через початок координат, на практиці не використовується, її відкидають, і значення вологовмісту переносять на горизонтальну лінію. Лінії d=const ідуть вертикально вгору паралельно осі ординат. Ізотерми в координатах Іd зображаються прямими лініями під певним кутом до осі абсцис. Кутовий коефіцієнт залежить від температури, чим вище температура, тим більше кутовий коефіцієнт.
Розділ 10. Термодинаміка потоку.
Розділ 10.1. І закон термодинаміки для стаціонарного потоку.
У більшості енергоперетворюючих установок відбувається переміщення робочого тіла в каналах певного профілю із значними швидкостями.
У цьому плані I закон термодинаміки враховує і зміну швидкості робочого тіла в каналі, і можливе переміщення каналів в просторі.
Розглядається рух газу в сталому каналі. В цьому випадку до потоку застосовується рівняння постійності витрати або рівняння нерозривності потоку:
![]()
W – швидкість
ρ - щільність протікаючого газу
f - площа перетину
Розділ 10.2. Наявна робота.
Розділ 10.3. Процеси течії газів та пари.
Течія - прискорений рух газів і пари через відносні канали відповідного профілю.
Сопло - канал де відбувається прискорення.
Дифузори - гальмування зі збільшенням Р.
Течія водяної пари

Умовно приймаємо значення
коефіцієнта n
= 1,3, для сухого насиченого k
= 1,135,
![]() - докритична,
- докритична,
![]() - критична. Надзвичайно важко встановити
для водяної пари критичний режим течії,
тобто визначити Ркр.
- критична. Надзвичайно важко встановити
для водяної пари критичний режим течії,
тобто визначити Ркр.
![]()
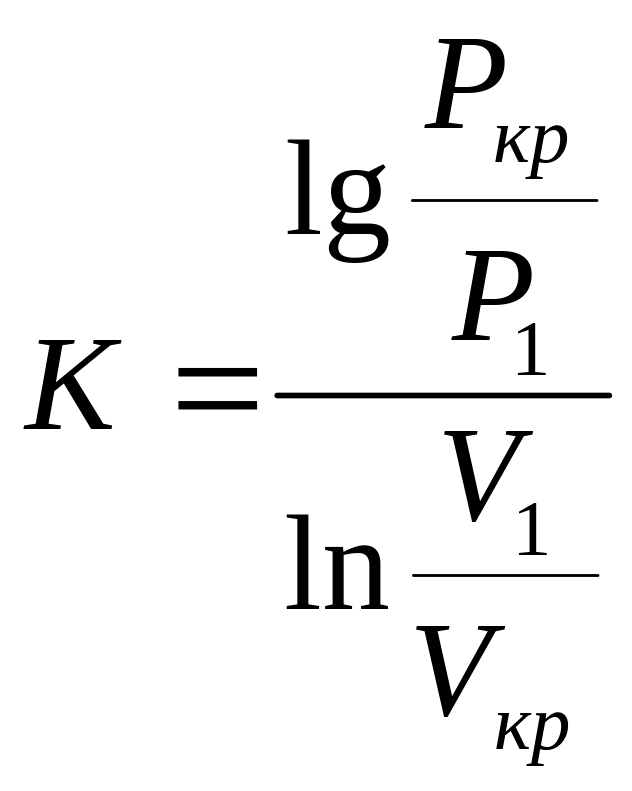
На початку приймають k = 1,3, але i-Ѕ діаграмі, вважаючи, що Ѕ1= Ѕкр знаходить Vкр і Рк уточнює значення до по формулі і повторюємо розрахунки до тих пір, поки значення Ркр не перестане змінюватися.
Розділ 10.4. Ізоентропійна течія газів та пари у каналах.
Розділ 10.5. Сопло Лаваля.
Розділ 10.6. Процеси змішування потоків. Ежектори.
Розділ 10.7. Дроселювання.
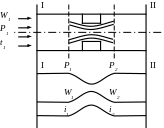
Дроселювання - процес зменшення тиску при проходженні газу або пари через звуження перетину (засувки, діафрагми). Як корисний цей процес використовують для регулювання виробництва парових і газових турбін в холодильних установках і приладах для вимірювання витрати засобів. У решті всіх випадків дроселювання шкідливе явище. При дроселюванні тепло може підводитися до трубопроводу або відводиться від нього. Розглянемо процес дроселювання без теплообмінника q = 0 і запишемо перший закон Термодинаміки для потоку.
![]()
![]()
![]()
![]()
Процес дроселювання відбувається при незмінній ентальпії.
![]()
![]()
![]()
Для реальних газів з урахуванням V молекул і F зчеплення між ними t при дроселюванні може збільшуватися, зменшуватися, і залишатися сталою.
![]()
![]()
![]()
![]()
Падіння t при дроселюванні наступає, коли
Якщо при дроселюванні t = const, то наступає стан інверсії. В результаті дроселювання t газів і пари зменшується.
Дроселювання водяної пари
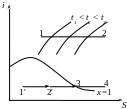
При дроселюванні перегрітої пари t падає. При дроселюванні вологої пари ступінь сухості зростає, а при тривалому дроселюванні пар може перетвориться на сухий насичений і навіть перегрітий.
Розділ 11. Компресорні установки
Розділ 11.1. Стискання газів та парів.
Пристрої, призначені для стиснення і нагнітання газів і пари - компресори. Залежно від принципу напряму стислого газу і від компресивності:
Об'ємні (поршневі)
Лопатеві (відцентрові, осьові)
Пароструйні (інжектори)
Незважаючи на відмінності в конструкції, процеси отримання стислого газу у всіх компресорах однакові, тому ми розглянемо на прикладі поршневого компресора.
Завдання розрахунку компресора: визначення роботи, витраченої для отримання стислого газу.
Розділ 11.2. Одно- та багатоступеневі компресори.
Одноступінчате стиснення газів:
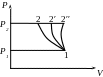

При русі поршня зліва на право відбувається заповнення циліндра газом (Р11). В цьому випадку основні параметри не змінюються і процес не термодинамічний, але щоб запустити газ в циліндр витрачається частина роботи. При зворотному русі поршня відбувається стиснення газу до Р2, причому процес може бути ізотермічним - (1-2′), адіабатним (1-2′′) і політропним (1-2). При подальшому русі поршня відбувається виштовхування стислого газу з циліндра в спеціальну ємність (ресівер) (2Р2). В цьому випадку параметри незмінні, але на виштовхування газу витрачається робота.
Для здійснення ізотермічного стиснення необхідний і інтенсивний тепловідведення, що практично неможливе, із-за економічних міркувань і із-за технічних умов.
Адіабатне стиснення проходить без теплообміну, але при цьому швидко повертає t газу, що стискається, і виникає небезпека вибуху компресорної установки, яка створена при t стискання газу 160-180ºС.
t К. При цій t випаровуються змащувальні масла і утворюються вибухонебезпечні суміші.
У реальних умовах К частково охолоджується повітрям і при цьому процес стиснення йде в політропном процесі з показником:
1< n <К
Процес між адіабатою і ізотермою

Робота, що витрачається на отримання стислого газу графічно рівна тій, що розташовується (площа між лінією процесу і віссю Р)
![]()
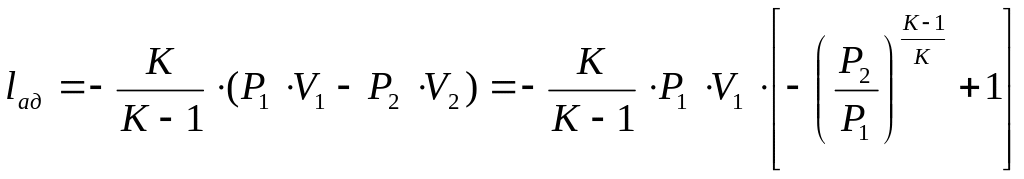
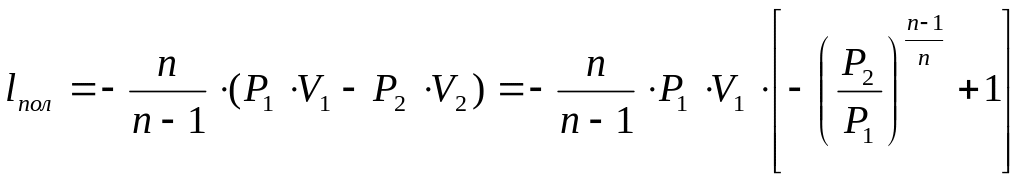
Багатоступеневе стиснення газу
Для того, щоб не ↓ продуктивність компресора при підвищенні Р газу і не допустити підвищення tº газу, що стискається, вище 160-180ºС використовують багатоступінчасте стиснення.
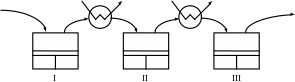
Газ, що стискається, поступає в I ступінь де стискається до Р через ступінь стиснення
![]()
Після I ступеня газ прямує в охолоджувач, який є теплообмінником (охолоджування газу водою, яка тече по трубам). Теоретично газ повинен охолоджуватися до первинної t, але в реальних умовах газ недоохолоджується на декілька градусів. Далі газ поступає в ІІ ступінь, де стискається при такій β:
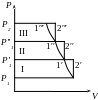
Р1 1 - наповнення циліндра в I ступені
1 2′ - стиснення газу в I ступені
2′ 1′ - охолоджування газу в охолоджувачі
1′ P1 P1′ 1′ - випуск і впускання
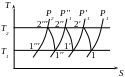
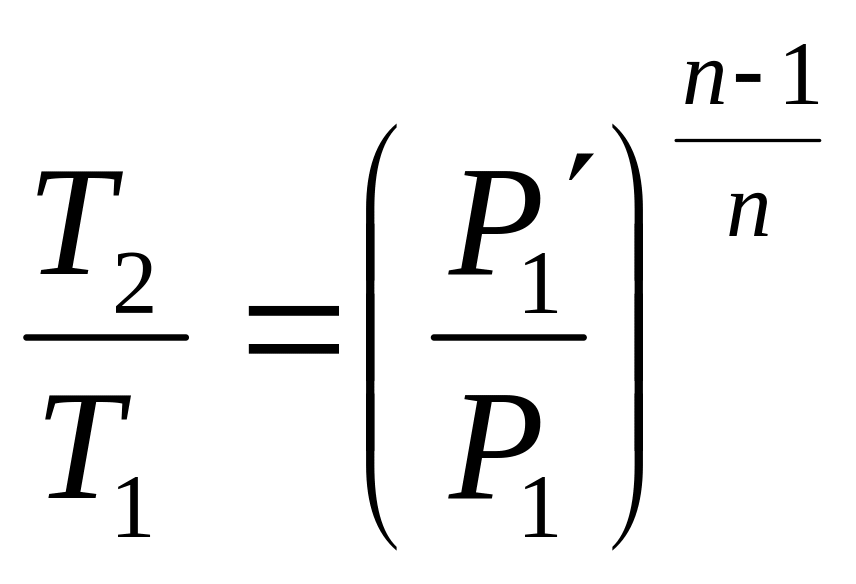 ;
;
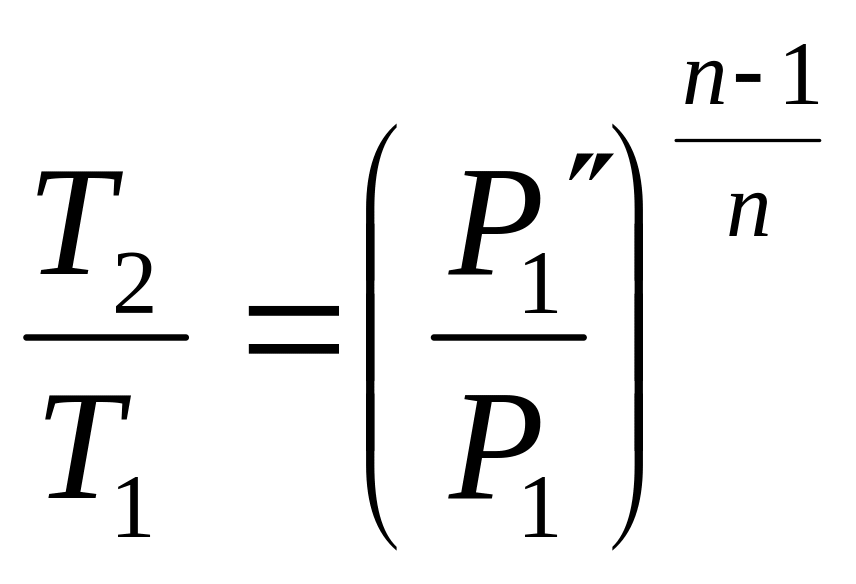 ;
;

![]()
![]()
![]()
![]()
При ІІ ступені:
![]()
Реальний процес стиснення в компресорі
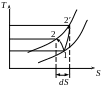
![]()
![]()
Теоретичний процес стиснення в Т-Ѕ координатах зображається оборотною адіабатою1-2. У реальних умовах при стисненні газу виникають Fтр молекул газу один об одного і об стінки циліндра. Робота тертя перетворюється на Q. Q сприймається газом, що стискається, унаслідок чого tº ↑ до Т2 і ентропія ↑. Тому необоротний адіабатний процес зображений лінією 1-2′.
![]()
![]()
Робота, що витрачається в реальних процесах стиснення буде більше теоретичної на величину роботи сил тертя.
Розділ 11.3. Турбокомпресори.
Розділ 11.4. Дійсна індикаторна діаграма одноступеневого компресора.
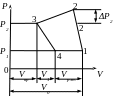
Р1-1 - впускання газу в циліндр.
1-2 - політропне стиснення.
2-Р2 - випуск стислого газу.
3-Р2 - шкідливий простір.
3-4 - розширення шкідливого простору.
Р1-1 - цикл замкнутий. Впускання газу.
У поршневому компресорі між верхнім майданчиком поршня і нагнітальними клапанами завжди залишається газ, цей простір називається шкідливим, а V газу, що знаходиться в шкідливому просторі - шкідливим V.
Після випуску стислого газу з циліндра в шкідливому просторі залишається газ Vвр. при Р2. Тому при русі поршня зліва направо спочатку розширюється газ в шкідливому просторі до Р1 і лише після того в циліндр починає поступати свіжий газ. Наявність шкідливого простору знижує продуктивність компресора, але з іншого боку компенсує удари поршня при проходженні його через внутрішню мертву точку.
Дійсно, індикаторна діаграма відрізняється від теоретичних тим, що із-за опору всмоктуючого каналу і клапанів процес наповнення циліндра йде при Р трохи менше початкового Р1. Для того, щоб отримати стислий газ при Р2 необхідно Р в циліндрі підвищити на ΔР2, яке витратиться на подолання опору нагнітального каналу і клапанів
V1 = 1′1; V2 = 1′′1; V3 = 1′′′1; V4 = 0
З діаграми видно, що при підвищенні Р стиснення газу виробництво компресора буде збільшуватися унаслідок розширення стислого газу в шкідливому просторі.
Т. При стисненні до Р2 виробництво компресора оцінюється - 1′1.
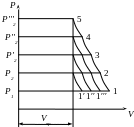
![]() ,
то V2
= 1′′1
,
то V2
= 1′′1
![]() ,
то V3
= 1′′′1
,
то V3
= 1′′′1
![]() ,
то V4
= 0
,
то V4
= 0
Оскільки процес розширення газу в шкідливому просторі йде по лінії стиснення у зворотному напрямі:
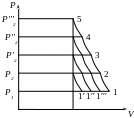
V1 = 1′1
V2 = 1′′1
V3 = 1′′′1
V4 = 0
З діаграми видно: при збільшенні Р, стиснення газу продуктивність знижується унаслідок розширення стислого газу в шкідливому просторі.
При стисненні Р2 продуктивність компресора оцінена 1′1.
Оскільки процес розширення газу в шкідливому просторі йде по лінії стиснення у зворотному напрямі. Така робота компресора називається позитивною. Але робота витрачається на стиснення газу і не зменшується при зменшенні продуктивності.
Розділ 12. Цикли двигунів внутрішнього згоряння (ДВЗ)
Розділ 12.1. Основні положення.
ДВЗ - всі двигуни внутрішнього згорання (поршневі, газотурбінні установки, реактивні і турбореактивні двигуни). При розгляді теоретичного ДВЗ застосовується спрощений метод дослідження на підставі якого:
1. Всі дійсні процеси що протікають в таких двигунах уподібнюються до теоретичних.
2. Процеси згорання горючої суміші, тобто процеси виділення теплоти, замінюються процесами підведення тієї ж кількості теплоти.
3. Дійсні цикли незамкнуті, але теоретично розглядаються, як замкнуті.
Розділ 12.2. Принцип дії ДВЗ.
Теоретична індикаторна діаграма чотирьохтактного поршневого ДВЗ:
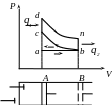
При русі поршня від А до В через відкритий всмоктуючий клапан циліндр заповнюється горючою сумішшю, при цьому всі параметри const, кількість суміші зростає - процес не термодинамічний. Від В до А відбувається стиснення горючої суміші (b-c), при цьому V зменшується, T і P зростають - процес адіабатний. В т. А суміш запалюється від іскри, яка проскакує через свічку. Процес згорання відбувається миттєво, при цьому Р і Т зростають, V = const, процес ізохорний (c-d). За рахунок зростання Р при згоранні, поршень рухається від А до В і відбувається згорання продукту згорання, при цьому V зростає, а Р і Т зменшуються - процес адіабатний (b-e). Відкривається вихлопний клапан і з різким звуком продукти згорання витікають в О.С., унаслідок того, що Рвн.цил>Ро.с., тобто процес вихлопу відбувається при нерухомому поршні. Р, Т зменшуються, а V = const - процес ізохорний (b-e). Продукти згорання, що залишилися, виштовхуються в навколишнє середовище при русі поршня від b до а, при цьому Р, V, Т = const - процес не термодинамічний.
Виключимо з розглянутих не термодинамічні процеси - отримаємо чотирьохтактний цикл ДВЗ.
Залежно від особливостей процесу згорання розрізняють цикли ДВЗ:
1. Зі згоранням суміші (V = const) - цикл Отта.
2. Зі згоранням суміші (Р = const) - цикл Дизеля.
3. Зі змішаним згоранням (Р, V = const) - цикл Трінклера.
Розділ 12.3. Цикл Отто.
Вперше ідею ДВЗ висловив Карно.
Першу конструкцію ДВЗ розробив француз Бо де Роша.
В 1873 році ученим Отто був побудований тепловий двигун. У двигуні використовувався світильний газ без стиснення і ККД був рівним 3-4%.
У 1876 році російський інженер Костовіч запропонував карбюраторний двигун:


Ці цикли поршневих ДВЗ працюють із зовнішнім сумішоутворенням, з примусовим запаленням робочої суміші, і в них використовується легкі сорти палива (бензин, спирт, газ).
Основним параметром циклу є ступінь стиснення.
![]()
![]() ;
;
![]() ;
;
![]()


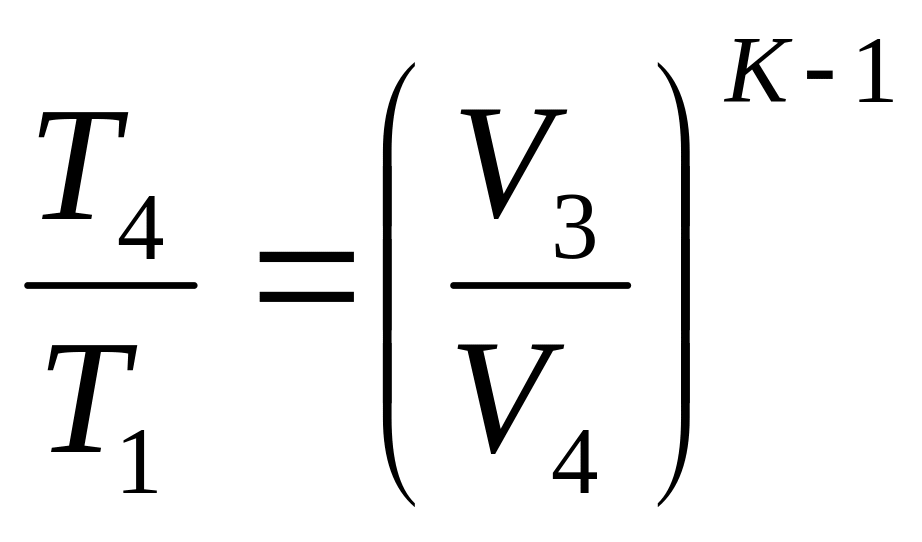
![]() ,
,
![]()
![]()
ККД залежить від K (робочого тіла), але у великій мірі від ε (ступені стиснення) і збільшується зі збільшенням ε. Але в даних конструкціях ДВЗ значення ступеня стиснення обмежена tвоспл вживаних сортів палива. При збільшенні ε вище допустимого може виникнути “детонаційний режим згорання”.
Розділ 12.4. Цикл Дізеля.
Цикл ДВЗ при згорянні палива при Р = const є цикл Дизеля.


Паливо подається в циліндр
в кінці процесу стиснення від паливного
насоса з Р>40
бар за допомогою дозуючих пристроїв
(форсунок). Розпилювання палива
здійснюється стислим повітрям від
компресора, який входить в частину
двигуна і споживає частину його
потужності. Таким чином, дизелі - двигуни
внутрішнього згорання з внутрішнім
самозайманням суміші. 1-2 - адіабатне
стиснення повітря; 2-3 - ізобарне згорання
горючої суміші;3-4 - процес адіабатного
розширення продуктів згорання. Ступінь
стиснення
![]() .
Ступінь попереднього розширення
продуктів згорання 0.
.
Ступінь попереднього розширення
продуктів згорання 0.
![]() ,
,
![]()
![]()
![]()
![]()
![]()
![]()
Недоліком цих двигунів є наявність компресора.
Розділ 12.5. Цикл Трінклера.
У двигунах, що працюють по цьому циклу здійснюється безкомпресорне механічне розпилювання палива в попередній камері. Механічне розпилювання палива в ДВЗ було запропоновано в 1904 році російським інженером Трінклером. Це ті ж самі д.д., у них також стискається повітря до тих же параметрів, що і в попередньому циклі. Паливо подається в циліндр за допомогою форсунок від високонапірних паливних насосів з тиском рівним 200-300 Вт. При стисненні повітря в циліндрі встановлюється тиск більше, ніж в попередній камері і повітря захоплює паливо. Рухається зі збільшенням швидкості в попередню камеру. Змінюється напрям руху на протилежний, в попередній камері частина палива згорає при V = const. І вже Р стає більшим ніж у циліндрі. Суміш складається з повітря, незгорілого палива і продукту згорання, зі збільшенням швидкості рухається з попередньої камери в циліндр. Запалення палива здійснюється в циліндрі при переміщенні поршнів Р = const.


Процес 2-3 - ізохорний процес часткового згорання палива в попередній камері; 3-4 - ізобарний процес допалювання горючої суміші в циліндрі.
,
![]()
![]() - ступінь розширення
- ступінь розширення
![]()
![]()
Розділ 12.6. Порівняння циклів.
1. Порівнюємо цикли ДВЗ при однакових ε (ступінь стиснення).

1234 - цикл Дизеля (Р = const)
123’4 - цикл Отто
12а3”4 - цикл Трінклера
У цих умовах найбільш економічним буде цикл ДВЗ з V = const (площа процесу найбільша), за цих умов порівняння циклів можна проводити тільки при ε відповідному карбюраторному двигуну.
Таким чином при невеликому ε дизельні двигуни та двигуни зі змішаним згорянням паливної суміші (Р = const, Р і V = const) будуть не економічні.
2. Порівнюємо цикли при однакових max Т.

121 34 - цикл Дизеля (Р = const)
1234 - цикл Отто (V = const)
12”а34 - цикл Трінклера (РV = const)
У даних умовах найбільш економічним є цикл Дизеля, але в цьому циклі ε (ступінь стиснення) 1-21 > ніж в циклі 1-2″ зі змішаним згорянням суміші.
3. Порівнюємо цикли при однакових ступенях стиснення.

P=const - 12314
Р і V = const – 12а34
У результаті порівнянь найбільш вигідним є цикл ДВЗ із змішаним згоранням горючої суміші.
Розділ 13. Цикли газотурбінних установок (ГТУ).
Розділ 13.1. Основні характеристики.
Схема пристрою. Принцип дії.

1 - Камера згорання
2 - Газова турбіна
3 - Повітряний компресор (осьовий або відцентровий)
4 - Паливний насос
5 - Паливний бак
6 - Форсунка
7 - Направляючі сопла
8 - Генератор
У камері згорання відбувається згорання рідкого або газоподібного палива, і розвивається температура порядку 2000ºС. Для зниження температури газів, що поступають на лопасті газової турбіни до 800-900ºС розбавляють продукти згорання повітрям від компресора. Йде повне розширення в газовій турбіні до тиску навколишнього середовища. Стінки камери згорання також охолоджуються повітрям від компресора.
Цикли ГТУ класифікуються залежно від способу спалювання горючої суміші в камері згорання і розрізняють:
Цикли ГТУ із згоранням палива при Р = const.
Цикли ГТУ із згоранням палива при V = const.
Розділ 13.2. Цикли ГТУ з підведенням теплоти при Р=const.


1-2 - адіабатне стиснення повітря в компресорі.
2-3 - ізобарний процес згорання палива в камері згорання.
3-4 - адіабатне розширення продуктів згорання в газовій турбіні.
4-1 - умовний процес охолоджування системи до первинного стану.
![]()
![]() - ступінь підвищення тиску
- ступінь підвищення тиску
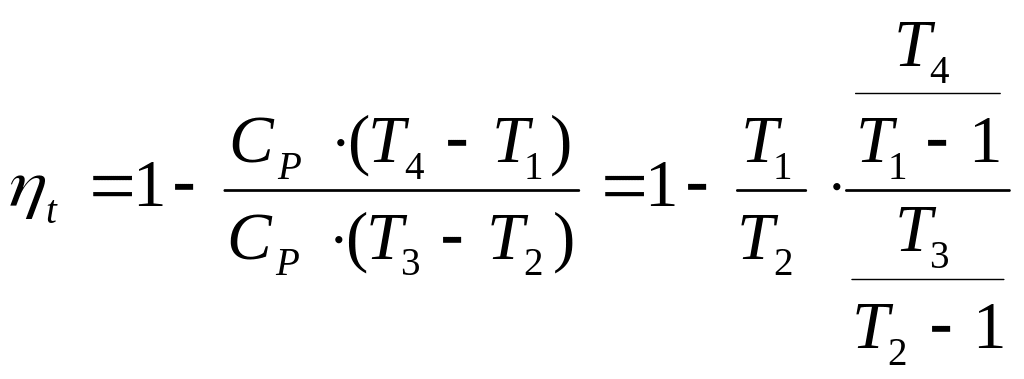
Для 1-2:
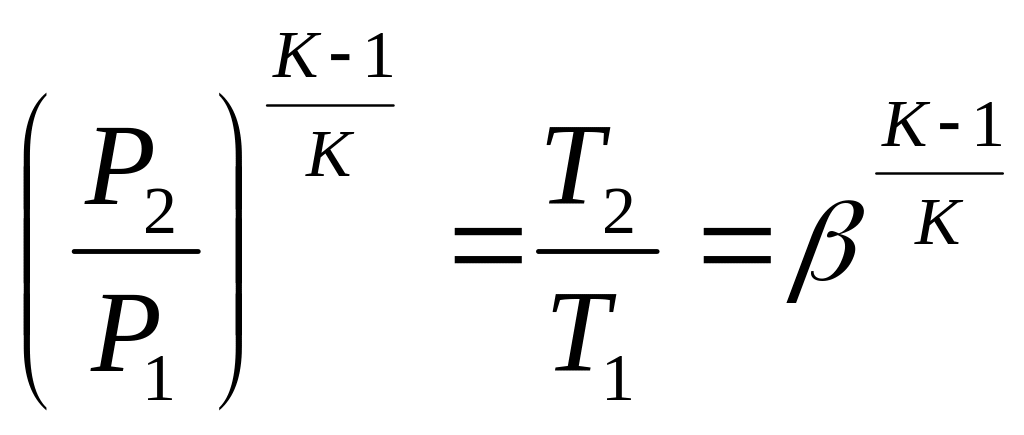
Для 3-4:
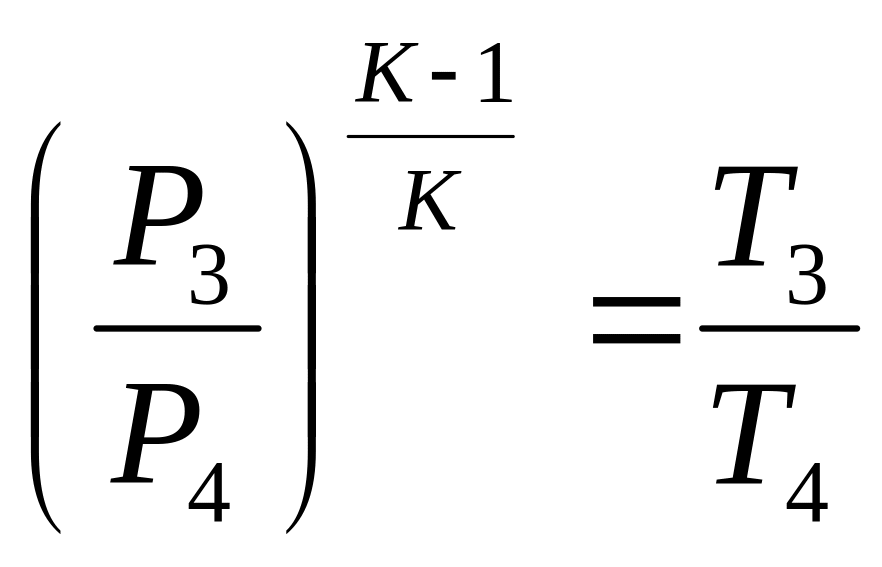
![]() ;
;
![]()
![]() ;
;
![]()

Термічний ККД ГТУ залежить прямо пропорційно від ступеня підвищення тиску в компресорі.
З урахуванням безповоротності процесу стиснення (1-2) повітря і розширення продуктів згорання (3-4) цикл ГТУ матиме вигляд:
Д ійсний
необоротний процес стиснення повітря
в компресорі зображається 12′ і робота,
що витратилася на стиснення повітря в
реальному процесі 12′ ↑ на величину
втрат енергії від безповоротності
процесу:
ійсний
необоротний процес стиснення повітря
в компресорі зображається 12′ і робота,
що витратилася на стиснення повітря в
реальному процесі 12′ ↑ на величину
втрат енергії від безповоротності
процесу:
![]()
Т0 - температура навколишнього середовища
Ѕ - в точках 1 і 2 однаково
У реальних процесах розширення газу в турбіні отримана робота ↓, на величину втрат пов'язаних з безповоротністю процесу розширення:
![]()
При відхиленні реальних процесів від теоретичних враховується внутрішня відносність коефіцієнту корисної дії.
Для компресора:
![]()
![]()
![]()
Для турбіни:
![]()
![]()
Ексергія повітря в реальному процесі стиснення збільшується на величину:
![]()
Ексергія газу при розширенні в турбіні зменшується на величину:
![]()
![]()
Розділ 13.3. Цикли ГТУ з підведенням теплоти при Р=const і з регенерацією.
Для ↑ ККД ГТУ нагрівають повітря після компресора (180ºС) газами після турбіни (450-500ºС), здійснюється повернення теплоти в циклі, тобто регенерацію теплоти.
Регенерація використовується у циклах, що мають точки з однаковою температурою.

У т. 4, 5 і 2, 6 однакова температура.
Оборотні процеси 1-2 та 3-4.
![]()
Тепло, що виділяється на ділянці 4-6 підводиться для нагріву повітря на ділянці 2-5 і в циклі кількість теплоти, що підводиться зменшується, нагрівання йде тільки на ділянці 5-3, і кількість Q, що відводиться, теж зменшується, оскільки нагрівання йде на ділянці 6-1.
В реальних умовах для скорочених габаритів теплообмінника нагрів повітря йде до t: t5′ < t5, а охолоджування газу до t: t6′ > t6. Реальну умову регенерації оцінюють степенем регенерації:
![]()
![]() ;
;
![]()
У реальних умовах гранична регенерація неможлива, оскільки при цьому площа теплообмінника прагне до нескінченності.
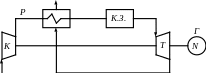
К - компресор
Т - турбіна
К.З. - камера згорання
Р - регенератор
Г - генератор

Реальний цикл з урахуванням
необратимих процесів 1-2′ та 1-4′.
![]() - те, що підводиться
- те, що підводиться
![]() - те, що відводиться
- те, що відводиться
![]()
Незалежно від застосування регенерації або при її відсутності, робота ГТУ залишається незмінною.
![]()
![]()
(ККД ГТУ) і робота зростають із збільшенням до певних меж.
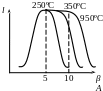
Подальше підвищення β приводить до зменшення роботи. Причому із збільшенням t робочого тіла, що поступає в турбіну, максимум роботи зміщується убік вищих β.
Розділ 13.4. Цикли ГТУ з підведенням теплоти при V=const.
Схема ГТУ залишається тією ж самою, змінюється конструктивно тільки КЗ: в неї вводиться три клапани, що дозволяють здійснювати процес згорання при V = const.
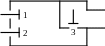
1 - повітряний клапан
2 - паливний клапан
3 - сопловий клапан


Через клапани 1 і 2 КЗ заповнюється паливом і повітрям. Передбачається примусове займання палива від іскри через свічку, потім відкривається сопловий клапан 3 і продукти згорання періодично поступають в турбіну.
2-3 - ізохорний процес згорання палива в КЗ. Якщо порівняти цикл, що вивчається, з циклом ГТУ при введенні палива, при Р = const, то цей цикл має велику Ѕ при однакових β, в РV: дає вигоду в роботі термічне ККД, але конструкція КЗ створює несприятливий пульсуючий режим роботи всієї установки, тому більшість сучасних ГТУ працюють по циклах із згоранням палива при Р = const.
![]()
Розділ 13.5. Порівняння циклів ГТУ.
Переваги ГТУ порівняно з ДВЗ.
1. Можливість отримання значних потужностей установки при невеликих габаритах і вазі установки.
2. Відсутність рідинного охолоджування значно спрощує конструкцію.
3. Мала витрата змащувальних матеріалів.
4. Простота конструкції і експлуатація.
Переваги ГТУ порівняно з ПТУ.
1. Відсутність котельної установки з її допоміжним господарством.
2. Простота пристрою газової турбіни порівняно з паровою.
3. Відсутність конденсатора.
4. Швидкий пуск і установка.
Розділ 13.6. Ексергетичний баланс ГТУ.
Приклад розрахунку ексергетичного балансу ГТУ наведений в методичних вказівках до курсової роботи «Розрахунок ексергетичних балансів газотурбінної та паротурбінної установок».
Виконати першу половину курсової роботи розрахунок ексергетичного балансу ГТУ згідно свого варіанту. Варіант вибирається по номеру залікової книжки.
Розділ 13.7. Цикли реактивних двигунів.
Всі реактивні двигуни діляться:
повітряно реактивні двигуни (ПРД)
турбоповітряні реактивні двигуни (ТПРД)
рідинно-реактивні двигуни (РРД)
Цикл ПРД
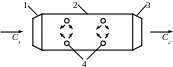
![]()
1 - вхідний дифузор
2 - камера згорання
3 - вихідне сопло
4 - форсунки
Вхідний потік повітря із С1 стискається в дифузорі за рахунок гальмування. Потім прямим потоком повітря поступає в КЗ, туди подається паливо (гас). Газоподібні продукти згорання розширюються у вихідному соплі і набувають значення С1. Отже утворюється реактивна сила R.
![]()


1-2 - адіабатне стиснення стрічного потоку в дифузорі
2-3 - ізобарний процес згорання в КЗ
3-4 - адіабатне розширення у виходах сопла
4-1 - умовний процес повернення
![]()
β – ступінь стиснення
![]() %
%
Літальний апарат, з цими двигунами використовується для польоту в повітряний простір з дозвуковою і надзвуковою швидкостями польоту.
При дозвуковій швидкості вихідне сопло має звужуючу форму.
При надзвуковій швидкості застосовується сопло Лаваля.
У ПРД відсутній рух перетворюючий Eкин у Eмех.
Цикл турбо-повітряно-реактивного двигуна (ТПРД)
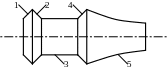
1 - дифузор
2 - компресор (осьовий, відцентровий)
3 – камера згоряння КЗ
4 - ГТ (газова турбіна)
5 - вихідні сопла
Для приводу вала компресора використовується турбіна, розташована за КЗ. У турбіні спрацьовує тільки частина загального тепло-перепаду, подальше розширення продукту згорання здійснюється у вихідних соплах.


1-а - стиснення повітря в дифузорі
а-2 - стиснення повітря компресора
2-3 - ізобарний процес згорання в КЗ
3-b - адіабатне розширення продукту згорання в газовій турбіні
b-4 - адіабатне розширення продукту згорання у вихідних соплах
4-1 - умовний процес
Двигун у якому процес згорання відбувається при V = const – пульсуючий (застосовується в авіації).
Цикл рідинно-реактивного двигуна (РРД)
РРД використовується для польоту в безповітряному просторі (ракетні двигуни). На борту літального апарату з РРД знаходиться запас необхідного окислювача і палива (тверде або рідке).
При використання твердого, запас запресовується в ємність, в якій роблять певного профілю канали, через які подається рідкий окислювач. В процесі окислення палива ↑ t, виділяється Q і утворюється газоподібні продукти окислення, які розширюються у вихідних соплах і створюють силу.

Оскільки V окислювача в РРД значно менший ніж V повітря в ТВРД або ВРД, то 1 визначається стан окислювача перед насосом можна розмістити на осі тиску. При роботі насоса Р збільшується при Т = const (1-2)
2-3 - ізобарний процес окислення палива
3-4 - адіабатний процес розширення газообмінних продуктів окислення у вихідних соплах
4-1 - умовний процес
Розділ 14. Цикли паросилових установок (ПСУ).
Розділ 14.1. Цикл Карно у паросилових установках.
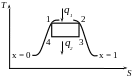
Т-Ѕ: 1-2 - ізобарно-адіабатний процес паротворення
2-3 - адіабатний процес розширення сухої насиченої пари з отриманням А
3-4 - ізобарно-ізотермічний процес конденсації
4-1 - процес стиснення пари з метою подальшого використання конденсату
Цей цикл не доцільним, оскільки для стиснення відпрацьованої вологої пари потрібні поршневі компресори з великим V циліндра. Робота на привід якого витрачає значну частину роботи, отриманої в циклі.
Розділ 14.2. Цикл Ренкіна.

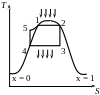
Цей цикл отримуємо з циклу Карно при повній компенсації пари. Конденсат подається в котельну установку насосом. А витрачена на привід насосу в 100-150 разів менше ніж А на привід компресора для стиснення пари.
Тконд < Ткип, тому в першу чергу потрібно нагрівати конденсат до стану кипіння.
1-2 - паротворення
2-3 – адіабатне розширення сухої насиченої пари
3-4 - повна конденсація пари
4-5 - процес перекачування насосом конденсату
5-1 - підігрів конденсату до Ткип


Робоче тіло є перегріта пара
6-1 - перегріта пара
Схема паросилової установки
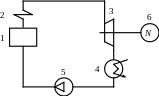
1 - котельна установка
2 - пароперегрівач
3 - парова турбіна
4 - конденсатор
5 - конденсаційний насос
6 - генератор
У 1 отримують суху насичену
пару при тиску tн
= f(Р).
Необхідний тиск створюється насосом
5. Перегріта пара розширюється в паровій
Т. до
глибокого вакууму. Границею вакууму є
tокр.ср.
Тому розширення пари в Т
йде
![]() бар.
бар.
![]()
![]()
Q – підводиться до кипіння в процесі нагрівання води (4-5), пароутворення (5-6), перегріву пари (6-1) і весь процес відбувається при P = const. Тепло відводиться в процесі конденсації (2-3), який іде при P = const.
![]()
![]()
![]()
Так як в 3 і 4 один і той же конденсат, то:
![]() :
:
![]() ;
;
![]() ;
;
![]()
![]()
h - висота адіабатного процесу при зображенні його в i-S системі

Користуючись i-S діаграмою можна знайти залежність підводимих і відводимих Q і роботи.
;
![]()
Для підвищення термічного ККД циклу паросилової установки необхідно прагнути до збільшення висоти адиабатного процесу розширення пари в турбіні (i-Ѕ діаграма). Для цього потрібно прагнути до підвищення параметрів перегрітої пари (у т.1) і вести розширення до можливого вакууму.
Розділ 14.3. Вплив параметрів водяної пари на ефективність роботи ПСУ.
Основними параметрами при А
паросилової установки вважаються:
початкове Р1,
Т1
і кінцеве Р2.
Формула
у вигляді
![]() ,
не відображує вплив параметрів у явному
вигляді.
,
не відображує вплив параметрів у явному
вигляді.
