
- •Розділ 1. Основні поняття і визначення.
- •Розділ 2. І закон термодинаміки.
- •I закон термодинаміки:
- •Розділ 3. Теплоємність ідеальних газів
- •Розділ 4. Термодинамічні процеси.
- •Розділ 5. Іі закон термодинаміки
- •Для оборотного циклу Карно ∑ приведених теплот завжди дорівнює 0.
- •II закон термодинаміки має статистичний, обмежений по застосуванню характер, тобто він не дотримується в мікросистемах і в умовах глибокого вакууму.
Розділ 2. І закон термодинаміки.
Розділ 2.1. Закон збереження енергії.
Рух – це спосіб буття матерії. Матерія без руху не існує, як не існує і рух без матерії.
Ломоносов вперше у загальному вигляді сформулював принцип збереження і перетворення енергії як закон перетворення матерії та руху.
У 1748 р. Ломоносов написав в листі до Л.Ейлера цей закон: «Всі зміни, що бувають у природі, відбуваються так, що коли до чого-небудь дещо добавилось, тог це віднімається від дечого іншого. Так, скільки матерії добавилось якому-небудь тілу, стільки ж відніметься від іншого… Тіло, яке своїм поштовхом приводить у рух інше, стільки ж втрачає від свого руху, скільки передає його штовхну тому».
У формулювання закону Ломоносовим не має конкретності, але воно містить чітке й повне означення суті закону збереження і перетворення матерії та енергії.
У 1840 р. Г. Гесс сформулював закон стосовно термохімічних процесів.
На основі закону збереження матерії для термодинамічної системи, відокремленої оболонкою, можна сформулювати закон збереження мас так – кількість підведеної до системи маси тп дорівнює сумі кількості маси, яка залишилася в системі (Δтс) і кількості маси, що виведена із системи (тв):
тп=Δтс+тв
Для теплотехнічного обладнання, яке працює безперервно (котел, турбіна) або періодично (двигун внутрішнього згоряння) в стаціонарному режимі, тобто параметри стану не змінюються в часі або змінюються періодично, кількість маси, що знаходиться в середині системи, є постійною: тс=ідет, Δтс=0 і тоді:
тп=тв
У 1842 р. Майєр встановив закон еквівалентності теплоти та роботи і визначив числове значення механічного еквівалента теплоти.
У 1843 р. Джоуль, а потім, незалежно від нього, в 1844 р. Ленц встановили цей закон для електричних і теплових явищ (закон Джоуля-Ленца).
У 1847 р. Гельмгольц, проаналізувавши велику кількість фізичних явищ (механічних, теплових, електричних та інших), сформулював закон у загальному вигляді.
У 1850 р. Клаузіус опублікував математичне доведення закону збереження енергії з поясненням особливостей переходу теплової енергії в інші види енергії. Цей закон читається так:
В ізольованій системі енергія не зникає безслідно і не виникає знову, вона лише переходить із одного виду в інший. Загальна сума всіх видів енергій залишається незмінною.
Розділ 2.2. Внутрішня енергія системи.
Під внутрішньою енергією вважають запас енергії самого робочого тіла, яка накопичується в нім за рахунок взаємодії з іншими тілами.
U включає кінетичну і потенційну енергії молекул, обертальну енергію молекул, енергію коливання атомів в молекулі, енергію електронів, внутріядерну енергію, енергію електромагнітного випромінювання.
При
дослідженні теплових процесів істотне
значення мають
![]() і
і
![]() .
.
Оскільки
оцінити значення внутрішньої енергії
робочого тіла в якомусь конкретному
стані не є можливим, то при аналізі
теплових процесів досить дізнатися
тільки зміну
![]() .
.
![]()
Для будь-якого робочого тіла по фізичному сенсу U є сумою Uп і Uк молекул.
![]()
Для
ідеального газу
![]() ,
оскільки нехтуємо силами взаємодії між
молекулами.
,
оскільки нехтуємо силами взаємодії між
молекулами.
![]()
Оскільки
![]() ,
а T
-
параметр, то і внутрішнє U
є
параметром і має всі властивості
параметрів.
,
а T
-
параметр, то і внутрішнє U
є
параметром і має всі властивості
параметрів.
Властивості U
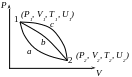 I.
I.
U як і всі параметри не залежить від характеру процесу:
![]()
 II.
II.
![]()
Оскільки
![]() і не залежить від характеру процесу, то
в різних по характеру процесах з однаковим
Δt
зміна
внутрішньої U
буде
однаковою:
і не залежить від характеру процесу, то
в різних по характеру процесах з однаковим
Δt
зміна
внутрішньої U
буде
однаковою:
![]()
1, 2 – процес ізохорний і тепло, що підводиться в цьому процесі можна визначити по формулах:
![]() ,
,
![]() ,
,
![]() ,
,
отже:
![]()
![]() ,
,
![]()
Видно, що ізохорна теплоємність CV по фізичному сенсу є мірою зростання внутрішньої енергії при зміні температури в ізохорному процесі.
1
кг:
U,
![]()
m
кг:
![]() ,
Дж
,
Дж
Внутрішня енергія є калоричною величиною.
Всі величини, що характеризують стан робочого тіла по чиннику залежності від маси діляться на інтенсивні - не залежні від маси робочого тіла (P, T, V) і екстенсивні - залежні від маси (V, U).
Розділ 2.3 Теплота і робота
Детальне вивчення закономірностей перетворення одних видів енергії в інші показує, що вони мають багато загальних властивостей, які не залежать ні від форми обміну енергією, ні від властивостей робочих тіл, які беруть участь в обміні енергією. Із багатьох видів енергії є тільки два принципово різних способи (форми) передачі енергії – робота і теплота.
Робота - це форма передачі енергії від одного тіла до іншого, яка супроводжується видимою зовнішньою зміною робочого тіла, тобто зміною його об'єму.
![]() ,
Дж
,
Дж
l - робота, здійснена 1 кг тіла.
m - маса робочого тіла.
![]() ,
,
Якщо розглянути роботу поршня в циліндрі, то її вираз можна записати у вигляді:

![]() -
робота, здійсненна 1 кг
-
робота, здійсненна 1 кг
де Р – тиск, з яким робоче тіло тисне на поршень, Па;
S – площа поршня, м2;
dh – висота, на яку підніметься поршень в результаті тиску.
![]() -
для всіх процесів
-
для всіх процесів
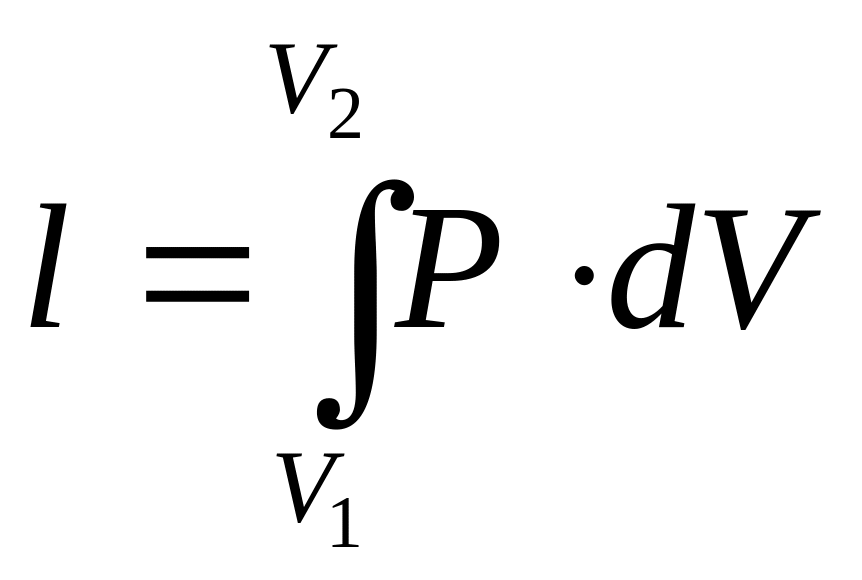
![]()

Графічно робота в P-V координатах є площею під процесом.
Тепло - це форма передачі енергії від одного тіла до іншого без видимих зовнішніх змін тіла, здійснюється за допомогою молекул тіла.
Для
1 кг:
![]() ,
,
Для
m
кг:
![]() ,
Дж
,
Дж
Розділ 2.4. Теплова взаємодія. Ентропія.
Через межу системи енергія може передаватися і формі роботи або теплоти. Як і робота, теплота не є функцією стану. Кількість теплоти, яка передається системі між двома певними станами, залежить від характеру процесу, від шляху, яким система переходить від одного стану в інший. Теплота є характеристикою процесу. Теплота передається тільки за наявності різниці температур від системи з вищою температурою до системи з нижчою. Робота і теплота є різними формами передачі енергії, тому не можна говорити, що тіло має запас теплоти чи роботи.
Великий внесок у розвиток уявлень про теплоту і роботу англійського фізика Д. Джоуля. Внаслідок проведених дослідів Джоуль установив, що між виконаною роботою і кількістю підведеної теплоти існує взаємозв’язок:
Q=AL
де А – коефіцієнт пропорційності, або механічний еквівалент теплоти.
Величина А є сталою і не залежить від способу отримання теплоти і роботи, температури тіла та ін. У разі виконання однакової роботи завжди отримуємо однакову кількість теплоти. Величина А залежить від вибору фізичних одиниць, і в Міжнародній системі одиниць (SI) А=1, тому що робота і теплота вимірюються в джоулях.
У зв’язку з хаотичністю теплового руху молекул неможливо знайти параметр, зміна якого характеризувала б зміну стану системи внаслідок передачі енергії у вигляді теплоти. Теоретичний аналіз теплових явищ, проведений Р. Клаузіусом у 1852-1864 рр., дав можливість йому зробити висновок, що елементарну кількість теплоти в рівноважному процесі можна розрахувати за загальною формулою енергетичної взаємодії, де інтенсивним параметром є термодинамічна температура Т, а екстенсивним – ентропія, яка позначається через S:
dQ=TdS
У 1852 р. Р. Клаузіус показав, що єдиною величиною, що характеризує теплову взаємодію, є величина, названа ним ентропією. Ентропія є координатою термічного стану системи. Хоча прямі виміри ентропії неможливі, Клаузіус показав, як її можна обрахувати через інші величини, котрі можна виміряти.
Температура системи змінюється або внаслідок передачі їй деякої кількості теплоти, або внаслідок виконання системою (чи над системою) деякої роботи. Тому за зміною температури не можна визначити, віддає чи одержує система енергію. Тільки зміна ентропії характеризує процес теплової взаємодії, оскільки температура завжди додатна величина.
Можна зробити висновок, що спільним між теплотою і роботою є те, що вони є енергетичними характеристиками процесів теплової та механічної взаємодії термодинамічної системи з навколишнім середовищем і мірою переданої кількості енергії.
Проте теплота і робота суттєво різняться між собою. Так, робота завжди і повністю переходить у теплоту (тертя). Теплота переходить в роботу лише за певних умов (наявність гарячого і холодного джерел енергії і робочого тіла). Пояснюється це тим, що робота – це передача упорядкованої форми енергії, а теплота – передача енергії хаотичного руху молекул.
Розділ 2.5. Рівняння І закону термодинаміки.
У циліндрі під поршнем 1 кг
реального
газу. При нагріванні газу зростає
кінетична енергія його молекул на
величину dK;
збільшується об'єм газу, а при збільшенні
об'єму реального газу збільшується
потенційна енергія його молекул (за
рахунок роботи по роз'єднанню молекул,
обумовленою силами зчеплення між ними)
на величину dP;
і здійснюється нескінченно мала робота
dl.
циліндрі під поршнем 1 кг
реального
газу. При нагріванні газу зростає
кінетична енергія його молекул на
величину dK;
збільшується об'єм газу, а при збільшенні
об'єму реального газу збільшується
потенційна енергія його молекул (за
рахунок роботи по роз'єднанню молекул,
обумовленою силами зчеплення між ними)
на величину dP;
і здійснюється нескінченно мала робота
dl.
![]()
Суму кінетичної і потенційної енергій молекул називають внутрішньою енергією робочого тіла (dU).
![]() -
1 кг
газу
-
1 кг
газу
![]() -
m
кг
-
m
кг
- 1 кг
![]() -
m
кг
-
m
кг
