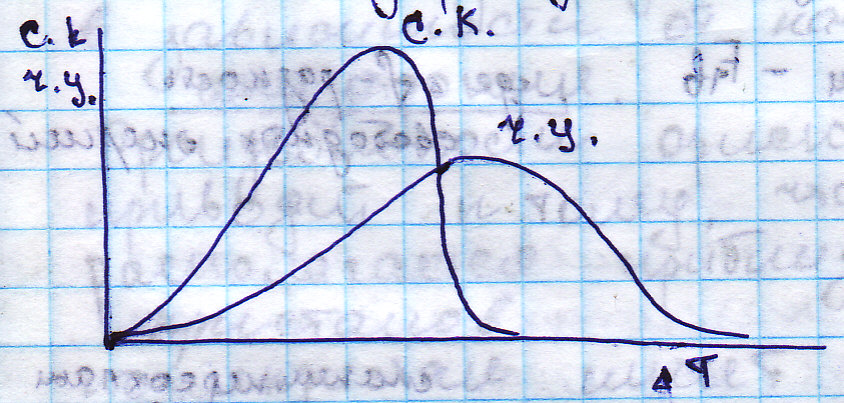- •3. Анизотропия свойств. Строение металлического слитка.
- •5. Наклеп, возврат и рекристаллизация, характер изменения свойств сплавов при этом.
- •11. Основные характеристики железа и углерода. Диаграмма состояния железо-цементит и ее анализ. Фазы, структурные составляющие, образующиеся по этой диаграмме, их свойства.
- •14. Формирование структуры белых чугунов (построение кривых охлаждения с применением правила фаз, графическое изображение итоговых структур).
- •25. Мартенситное превращение. Строение и свойства мартенсита закалки. Основные особенности мартенситного превращения. Критическая скорость охлаждения при закалке.
- •34. Причины введения легирующих элементов в сталь. Распределение легирующих элементов в стали. Влияние легирующих элементов на полиморфизм железа.
- •44. Быстрорежущие стали, их структура и особенности термической обработки.
1. Атомно-кристаллическое строение металлов. Основные типы кристаллических решеток металлов. Явление полиморфизма. Атомы в Ме и в других кристаллических тв.т., располагаются в пространстве закономерно, периодически повторяясь в 3-х измерениях через определенные промежутки, т.е. они образуют кристаллическую решетку. Существует 7 основных типов к/р: 1). Обемно центрированная кубическая (ОЦК): кристаллическая ячейка характеризуется
А) Б) В) Г) Д) |
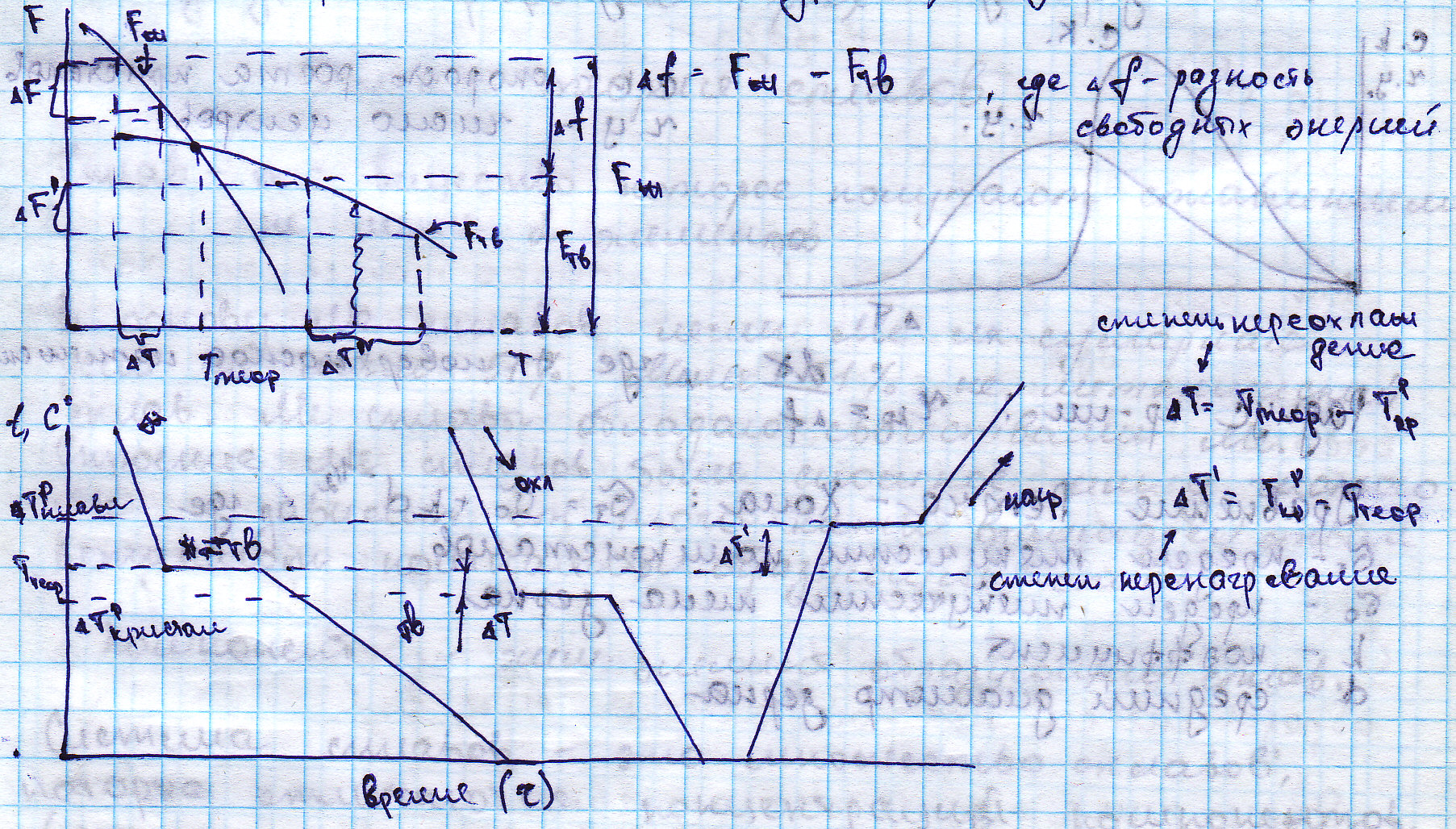
2. Механизм процесса кристаллизации сплавов. Процесс кристаллизации бывает первичным и вторичным, при этом под первичным понимают когда Ме переходит из жидкого в твердое, если кристаллизация протекает в твердом, то это вторичный процесс. Существует t плавления и t кристаллизации. Переход из одного состояния в другое происходит под действием термодинамического фактора. Энергетическое состояние системы имеющей огромное число охваченных тепловым движением атомов характеризуется особой термодинамической функцией (F – свободная энергия системы) при этом можно сказать, чем больше свободная энергия системы, тем система менее устойчива и при наличии возможности система переходит в состояние с меньшей свободной энергией. Рассмотрим кристаллизацию с точки зрения термодинамики:
|
![]() Из схемы видно: 1). процесс сначала
ускоряется пока в какой-то момент времени
(как правило 50% крист-ии) взаимное
столкновение не начинает заметно
препятствовать росту при этом кол-во
жидкости уменьшается. 2). пока кристалл
окружен жидкостью он часто имеет
правильную форму, но за счет столкновения
и срастания кристаллов правильная форма
нарушается. Скорость процесса крист-ии
количественно опр. 2 факторами: 1). скорость
роста кристаллов; 2). число зарождающихся
кристаллов в ед. времени. с.к. – скорость
роста кристаллов. ч.ц. число центров.
Из схемы видно: 1). процесс сначала
ускоряется пока в какой-то момент времени
(как правило 50% крист-ии) взаимное
столкновение не начинает заметно
препятствовать росту при этом кол-во
жидкости уменьшается. 2). пока кристалл
окружен жидкостью он часто имеет
правильную форму, но за счет столкновения
и срастания кристаллов правильная форма
нарушается. Скорость процесса крист-ии
количественно опр. 2 факторами: 1). скорость
роста кристаллов; 2). число зарождающихся
кристаллов в ед. времени. с.к. – скорость
роста кристаллов. ч.ц. число центров.
|
Уравнение Петча-Хола: σт=σo+kd-1/2 , где σт – предел текучести поликристаллов, σo – предел текучести тела зерна, k – коэффициент, d – средний диаметр зерна.
3. Анизотропия свойств. Строение металлического слитка.
|
4. Дефекты кристаллического строения. В действительности реальные кристаллы содержат те
А) Б) |
5. Наклеп, возврат и рекристаллизация, характер изменения свойств сплавов при этом.
А) Б) |
6. Общая характеристика сплавов. Компонент, фаза, система. Виды взаимодействия компонентов в сплавах. Правило фаз. Связь между свойствами сплавов и типом диаграммы состояния. Сплав – это вещество которое получают сплавлением не менее 2 элементов. В основу Ме сплавов легли Ме их суммарная доля не менее 51%, менее 51% не Ме сплав. Ме сплавы обладают св-ами Ме. Строение Ме сплавов более сложное чем у чистого Ме и зависит от того в какие взаимодействия вступают компоненты образующие сплав. Компонент – хим. элемент образующий сплав. Система сплавов – это множество сплавов, которые отличаются концентрацией компонентов. Фаза – однородная, иногда малая по объему часть системы, которая имеет 1 агрегатное состояние, обладает одинаковыми св-ами в любой ее части. Она отделяется от других частей сплава границей раздела при переходе через которую наблюдается скачек физикомеханических св-в. В тв. состоянии внутри сплава компоненты могут взаимодействовать:
А) Б) |
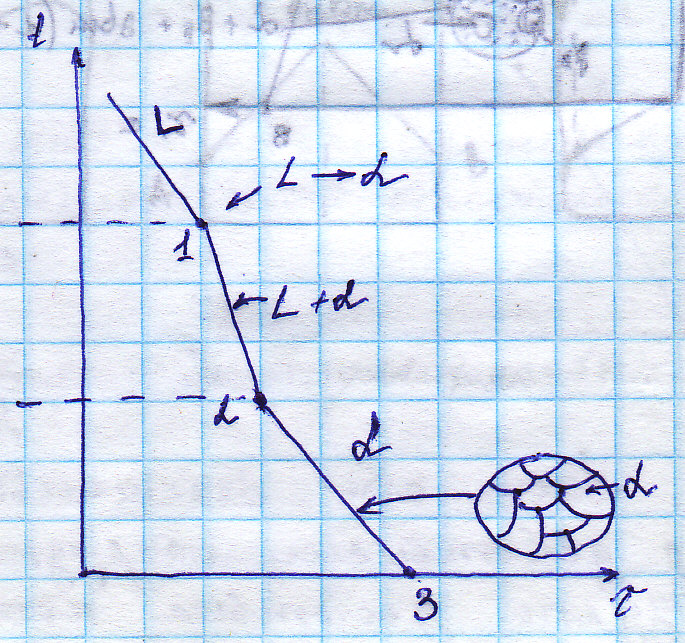
7. Диаграмма состояния I рода (с образованием механической смеси компонентов). Правило отрезков, определение с его помощью химического состава фаз, фазового и структурного состава, весовой доли. Примеры построения кривых охлаждения с применением правила фаз. Оба ком-та неограниченно растворимы в L состоянии, а в тв. нерастворимы и не образуют
|
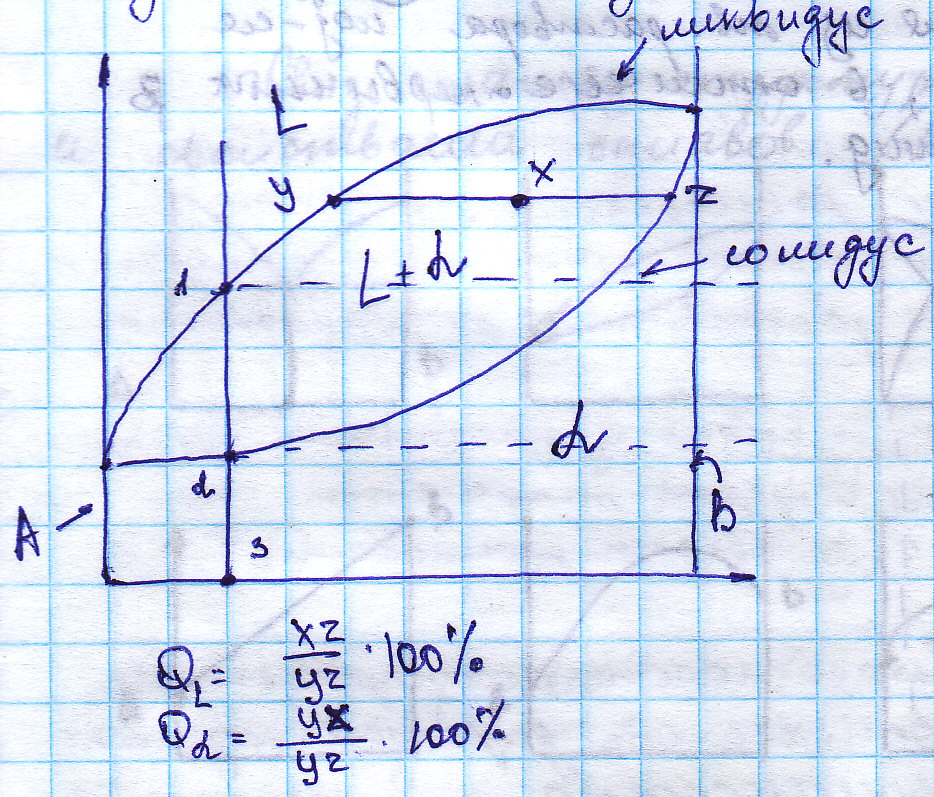
8. Диаграмма состояния II рода (с неограниченной растворимостью компонентов в жидком и твердом состояниях). Правило отрезков, определение с его помощью химического состава фаз, фазового и структурного состава, весовой доли. Примеры построения кривых охлаждения с применением правила фаз. Оба компонента неограниченно растворимы как в L,
|
Структура всех сплавов данного типа при комнатной t будут подобными, однородные кристаллы тв. раствора α, являются ед. структурной составляющей. Правило отрезков: из заданной точки диаграммы состояния необходимо провести отрезок горизонтали влево и вправо до пересечения с границами ближайших однофазных областей, а затем на этом отрезке необходимо отметить все его точки контакта с однофазными областями.
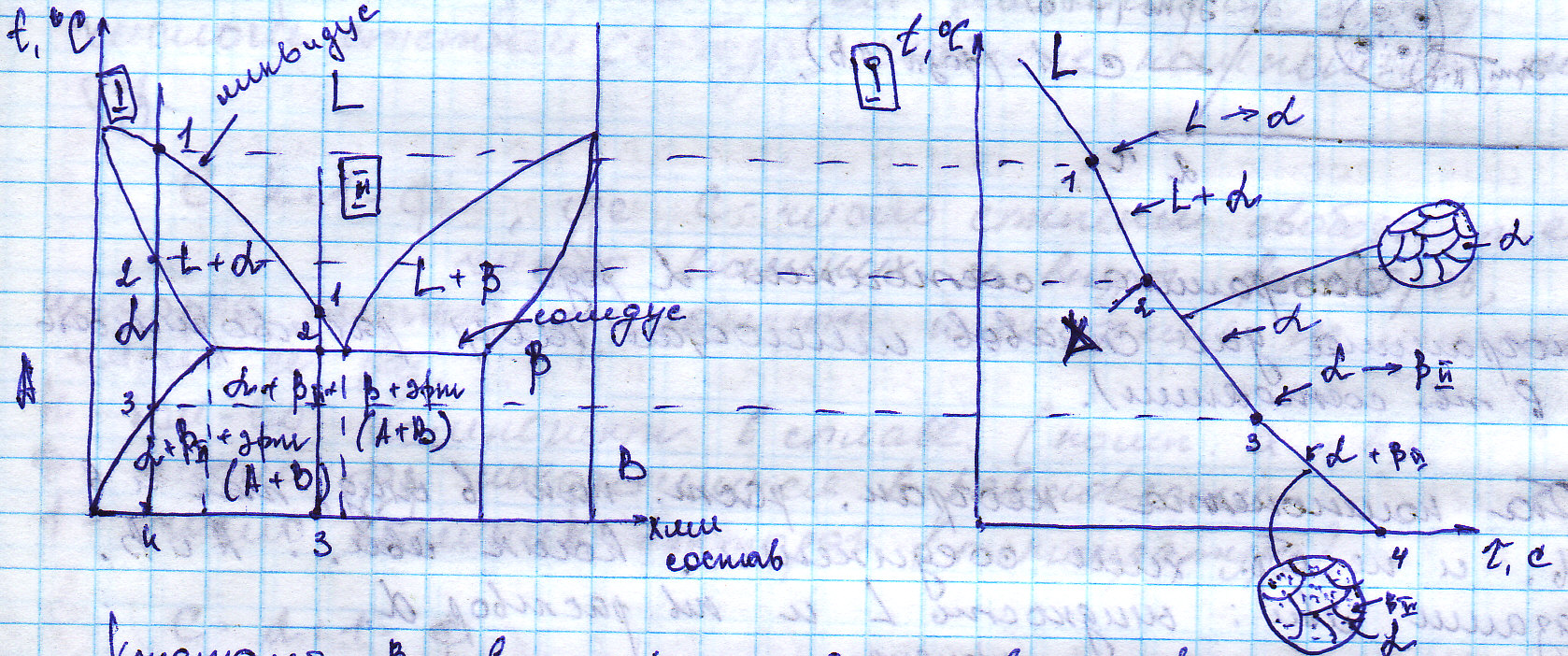
9. Диаграмма состояния III рода (с ограниченной растворимостью компонентов в твердом состоянии). Правило отрезков, определение с его помощью химического состава фаз, фазового и структурного состава, весовой доли. Примеры построения кривых охлаждения с применением правила фаз. Оба комп-та неограниченно растворимы в жидком состоянии,
|
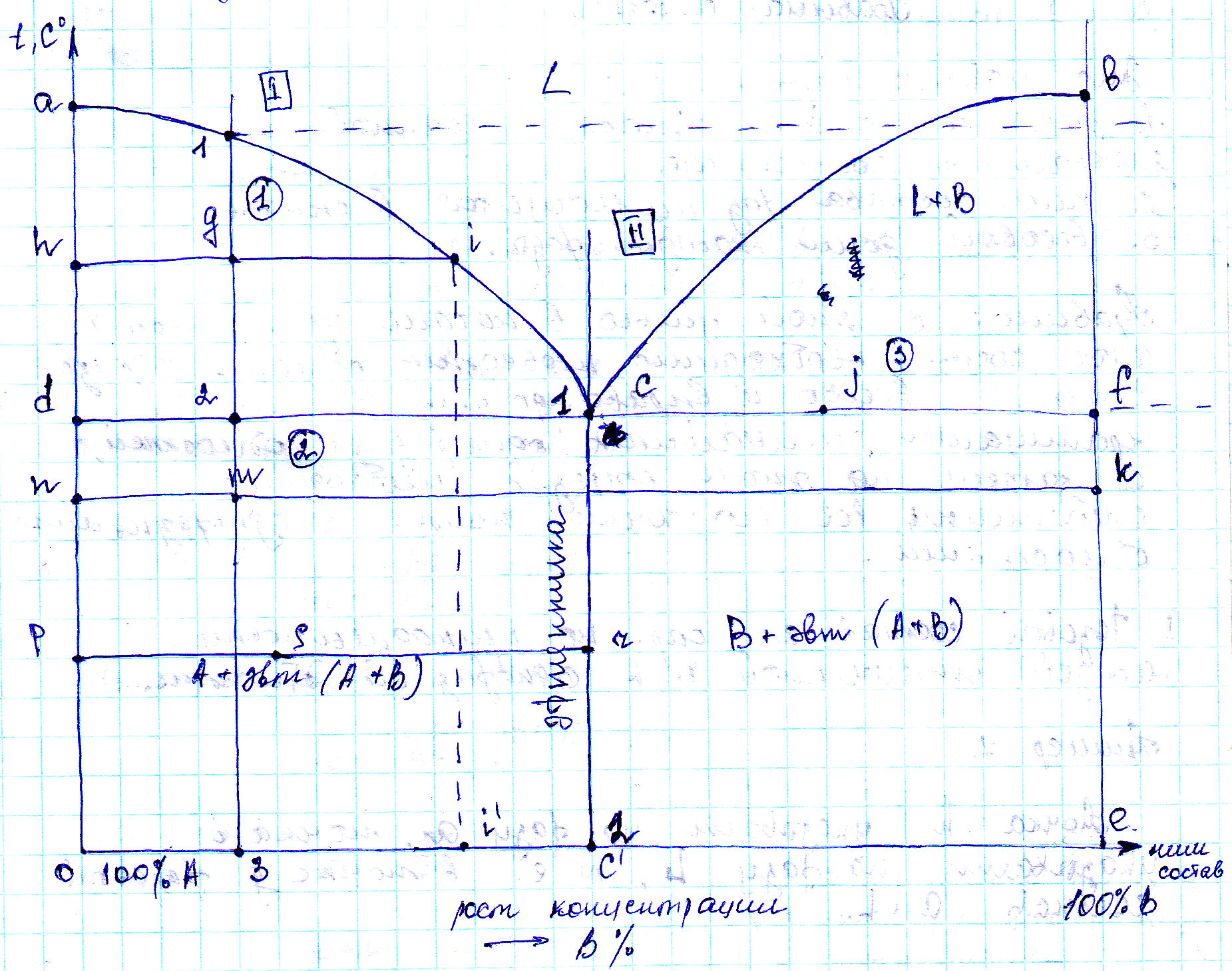
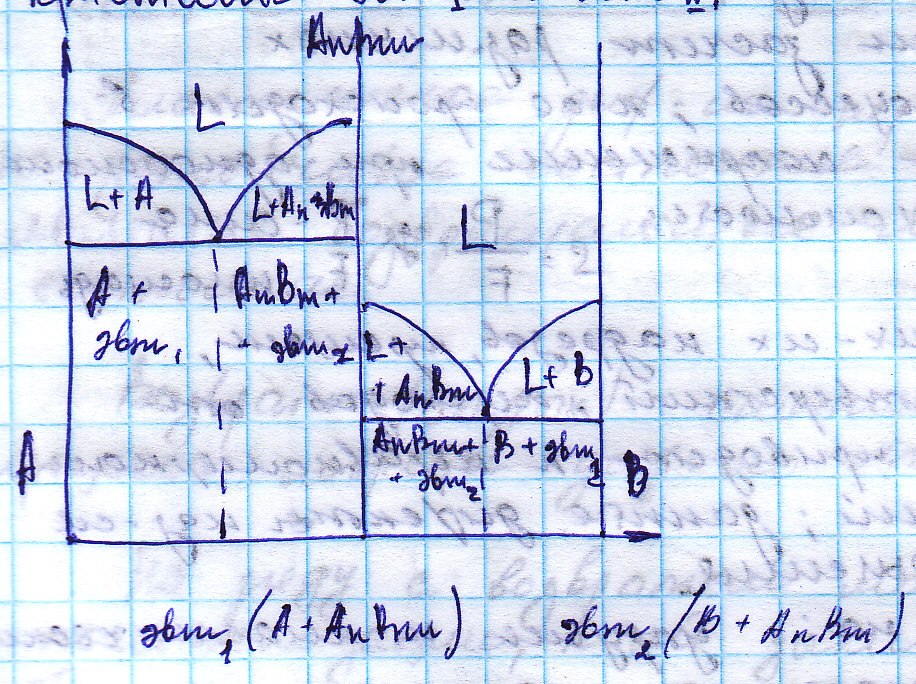
10. Диаграмма состояния IV рода (с устойчивым химическим соединением). Правило отрезков, определение с его помощью химического состава фаз, фазового и структурного состава, весовой доли. Примеры построения кривых охлаждения с применением правила фаз. Оба комп-та неограниченно растворимы в L состоянии, не растворимы в тв. и образуют хим. соединения. Комп-ами являются: A и B; фазами: L, A, B, хим. соединения An, Bm; структурный состав: кристаллы A, B, An, Bm, кристаллы эвтI и эвтII. Правило отрезков: из заданной точки диаграммы состояния необходимо провести отрезок горизонтали влево и вправо до пересечения с
|