
- •1)Дати загальну характеристику неметалічніх елементів. Пояснити явище алотропії а конкретних прикладах. Розкрити хімічні властивості неметалів.
- •2)Оксиди неметалів, їх хімічний характер і властивості.
- •3)Сполуки неметалів з гідрогеном. Амоніак, його властивості і застосування.
- •4)Сульфатна кислота, її властивості , якісна реакція на сульфат-йон.
- •5)Нітратна кислота, нітрати, вплив нітратів на живі організми.
- •6)Ортофосфатна кислота, поняття про мінеральні добрива.
- •7)Особливості карбонатної кислоти, значення карбонатів, твердість води і методи її усунення.
- •8)Загальна характеристика металів,їх поширення в природі, практичне застосування. Поняття про корозію.
- •Понятие о коррозии металлов
- •9)Металічний зв’язок , фізичні і хімічні властивості металів.
- •10)Лужні і лужноземельні метали, їх біологічна роль, практичне застосування.
- •11)Алюміній як амфотерний метал, властивості його оксиду і гідроксиду, практичне застосування алюмінію.
- •12)Ферум як метал побічних підгруп, його будова, властивості, застосування.
- •13)Роль металів і сплавів в сучасній техниці.
- •14)Теорія будови органічних сполук о.М.Бутлерова, явище ізомерії.
- •15)Причини багатоманітності і різноманітності органічних сполук.
- •16)Вуглеводні: алкани, алкени алкіни, дієни, Їх будова, номенклатура, властивості, застосування.
- •Гомологи метану
- •17)Природні джерела вуглеводнів: нафта, природний газ. Способи переробки нафти.
- •18)Оксигеновмісні органічні сполуки: спирти, альдегіди , карбонові кислоти, естери. Їх хімічна будова, функціональна група, номенклатура, властивості, застосування.
- •19)Жири як естери, їх склад, фізичні і хімічні властивості, біологічне значення, практичне застосування.
- •20)Вуглеводи: їх склад, будова, біологічні функції, застосування.
- •21)Нітрогеновмісні органічні сполуки: аміни, амінокислоти. Здатність амінокислот утворювати поліпептиди.
- •22)Білки: їх склад, просторова будова, фізичні властивості, біологічні функції, практичне застосування.
- •23)Методи якісного визначення білків.
- •24)Полімерні матеріали, пластмаси. Полімерні матеріали
- •25)Хімія і їжа, вітаміни, харчові добавки.
- •26)Роль хімії в медицині.
- •27)Хімія та побут: побутові хімікати.
21)Нітрогеновмісні органічні сполуки: аміни, амінокислоти. Здатність амінокислот утворювати поліпептиди.
Амінокислоти —
це органічні сполуки,
що містять дві функціональні
групи:аміногрупу — ![]() і карбоксильну
групу —
і карбоксильну
групу — ![]() .
.
Назви
амінокислот походять від назв відповідних
кислот із додаванням префіксааміно-:
амінооцтова, аміномасляна тощо. Також
застосовуються тривіальні назви,
наприклад амінооцтова кислота називається
гліцином.
Ізомерія амінокислот. У
сполуках із двома різними функціональними
групами атоми Карбону позначаються
грецькими буквами ![]() ,
, ![]() ,
, ![]() і
т. д.:
і
т. д.:
Залежно від того, до якого атома Карбону приєднана аміногрупа, амінокислоти поділяють на -, -, -амінокислоти і т. д.:
 У
живих організмах зустрічаються
тільки
-амінокислоти.
У
живих організмах зустрічаються
тільки
-амінокислоти.
Фізичні властивості амінокислот. Амінокислоти — тверді кристалічні речовини, добре розчинні у воді й малорозчинні в органічних розчинниках. Плавляться за температури, що перевищує 250 °C. Багато амінокислот солодкі на смак.
Поширення амінокислот у природі. Амінокислоти існують у всіх живих організмах. Вони є структурними одиницями білків і беруть участь в обміні речовин. Людина одержує їх у складі білкової їжі. Хімічні властивості амінокислот. Хімічні властивості амінокислот визначаються функціональними групами, що входять до їхнього складу. Карбоксильна група — носій кислотних властивостей, а аміногрупа — основних, тому амінокислоти належать до амфотерних сполук. Цим зумовлена властивість молекул амінокислот реагувати одна з одною. У реакцію вступають карбоксильна група однієї амінокислоти й аміногрупа іншої. При цьому утворюється молекула води, зв’язок, який виник, називається пептидним, а сполука, що утворилася, — ди-, три-, …, поліпептидом. Реакція утворення дипептиду:
 Група
–CO–NH–
називається пептидною
групою.
Група
–CO–NH–
називається пептидною
групою.
Реакції, в результаті яких разом з високомолекулярним продуктом утворюється також низькомолекулярний продукт, наприклад вода, називаються реакціями поліконденсації. Макромолекули поліпептидів складаються не з амінокислот, а з амінокислотних залишків.
Білки
Білки — це макромолекулярніорганічні сполуки(біополімери), структурну основу яких складають поліпептидні ланцюги, побудовані із залишків ?-амінокислот.У побудові білкових молекул беруть участь двадцять -амінокислот. Білки мають декілька рівнів просторової організації.Первинна структура білка — це послідовність амінокислот у поліпептидному ланцюзі. Вторинна структура — утворення поліпептидним ланцюгом -спіралі або -шару. Третинна структура — просторова укладка поліпептидного ланцюга. Четвертинна структура — об’єднання декількох поліпептидних ланцюгів з третинною структурою. Різноманітність білків, їх значення в природі. Білки входять до складу всіх живих організмів. Вони виконують безліч функцій, зокрема будівельну й ферментативну.
Фізичні властивості білків. Одні білки розчинні, інші — ні. Багато білків утворюють колоїдні розчини. Білки мають різний смак, колір і запах. Температури, за яких відбувається руйнування білка, специфічні для кожного з них.
Хімічні властивості білків.
1) Під дією деяких чинників відбувається руйнування тривимірної структури білка — денатурація, пов’язане зі зміною четвертинної, третинної та вторинної структур; денатурація може бути оборотною і необоротною. Чинники, що викликають денатурацію білків:.
— нагрівання;
— випромінювання, наприклад інфрачервоне або ультрафіолетове;
— сильні кислоти, сильні луги, концентровані розчини солей (у разі тривалої дії розриваються навіть пептидні зв’язки); — важкі метали;
— органічні розчинники (використання спирту як дезінфікуючого засобу базується на тому, що він викликає денатурацію білків бактерій).
2) Найважливіша хімічна властивість білків — здатність до гідролізу, який може проходити при нагріванні з сильними кислотами або лугами(кислотно-основний гідроліз),а також під дією ферментів(ферментативний гідроліз). Гідроліз призводить до розриву пептидних зв’язків з утворенням вільних амінокислот. Наприклад, кислотний гідроліз:
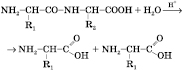 де
R1
і R2
— радикали амінокислот.
де
R1
і R2
— радикали амінокислот.
3) Якісні кольорові реакції білків:
— біуретова реакція на пептидні зв’язки — дія розбавленого розчину купрум(II) сульфату на слабколужний розчин білка, супроводжується появою фіолетово-синього забарвлення розчину; — ксантопротеїнова реакція на ароматичні та гетероядерні цикли — дія концентрованої нітратної кислоти з появою жовтого забарвлення.
