
Лекция Атомное ядро
Состав и характеристика атомного ядра
Состав ядра. Экспериментально установлено, что атомное ядро состоит из протонов и нейтронов. Эти частицы называют нуклонами.
Протон (р) обладает положительным зарядом е и массой

где mе — масса электрона, а.е.м. — атомная единица массы. Значение массы протона приведено в энергетических единицах как принято в ядерной физике.
Протон имеет спин s = 1/2 и собственный магнитный момент
![]()
г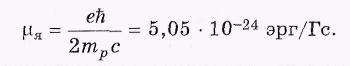 де
mя
— ядерный
магнетон (единица, в которой измеряют
магнитные моменты нуклонов):
де
mя
— ядерный
магнетон (единица, в которой измеряют
магнитные моменты нуклонов):
Ядерный магнетон в 1836 раз меньше магнетона Бора, т. е. собственный магнитный момент протона в 660 раз меньше магнитного момента электрона.
Н ейтрон
(n).
Его электрический заряд равен нулю, а
масса близка к массе протона:
ейтрон
(n).
Его электрический заряд равен нулю, а
масса близка к массе протона:
что на 0,14% или 2,5 mе больше массы протона.
Атомная единица массы равна 1/12 массы нейтрального атома 12С, т. е. 1 а.е.м. = 1,66·10-24 г или 931,50 МэВ.
Спин нейтрона s = 1/2 и, несмотря на отсутствие электрического заряда, нейтрон имеет магнитный момент
![]()
Знак минус означает, что «направления» спина и магнитного момента у нейтрона взаимно противоположны.
В свободном состоянии нейтрон нестабилен и самопроизвольно распадается, превращаясь в протон и испуская электрон и еще одну частицу, нейтрино (v):
![]()
Период полураспада (время, за которое распадается половина первоначального количества нейтронов) равно примерно 12 мин.
Характеристики атомного ядра. Основными величинами, характеризующими атомное ядро, являются зарядовое Z и массовое А числа. Число Z равно количеству протонов в ядре и определяет его электрический заряд Ze. Его также называют атомным номером. Массовое число А определяет число нуклонов в ядре. Число нейтронов в ядре
N = А - Z.
Символически эти характеристики ядра обозначают так:
![]()
где под X
имеется в виду химический символ
элемента, которому принадлежит данное
ядро, например,
![]() Н,
Н,![]() Hе,
Hе,![]()
![]() U
и т. д.
U
и т. д.
Конкретные атомы с данным числом протонов и нейтронов в ядре принято называть нуклидами. Нуклиды с одинаковым числом протонов (т. е. принадлежащие одному химическому элементу) называют изотопами.
Атомы изотопов
обладают практически очень близкими
физико-химическими свойствами. Это
связано с тем, что на строение
электронной оболочки атома ядро влияет
в основном только своим электрическим
полем. У изотопов эти поля одинаковы,
за исключением некоторых случаев.
Сильнее всего это различие у трех
нуклидов:![]() Н,
Н
и
Н,
Н
и
![]() H,
ядра которых также существенно отличаются
друг от друга. Поэтому этим трем нуклидам
присвоены разные названия — соответственно
обычный водород, дейтерий
и тритий,
а ядра дейтерия и трития — дейтрон
(d)
и тритон
(t).
H,
ядра которых также существенно отличаются
друг от друга. Поэтому этим трем нуклидам
присвоены разные названия — соответственно
обычный водород, дейтерий
и тритий,
а ядра дейтерия и трития — дейтрон
(d)
и тритон
(t).
У разных атомов число изотопов различно, среди них имеются стабильные и радиоактивные.
Размеры ядер. У атомного ядра (как и у всякой квантовой системы) нет четко определенной границы. В экспериментах по рассеянию электронов и нуклонов на ядрах установлено, что в каждом ядре имеется внутренняя область, в которой плотность ρ ядерного вещества практически постоянна, и поверхностный слой, где эта плотность падает до нуля. Типичное распределение концентрации нуклонов в зависимости от расстояния до центра ядра, т. е. п(г) показано на рисунке
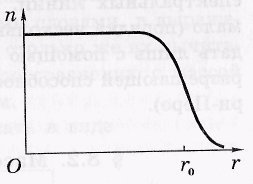
где rо — радиус ядра — расстояние от центра ядра, на котором концентрация нуклонов падает в два раза.
В первом приближении ядро можно считать сферическим радиуса
![]()
где 1 фм = 10-13
см. Из этой формулы вытекает важный
вывод: масса ядра, определяемая массовым
числом А,
пропорциональна его объему V,
поскольку V
~ г![]() ~ А.
Следовательно, плотность вещества
во всех ядрах примерно одинакова и, как
показывает расчет, равна ρ
~ А.
Следовательно, плотность вещества
во всех ядрах примерно одинакова и, как
показывает расчет, равна ρ
![]() 2·1014
г/см3
.
2·1014
г/см3
.
Масса и энергия связи ядра
Масса ядра не является аддитивной величиной: она не равна сумме масс образующих ядро нуклонов. Причиной является сильное взаимодействие нуклонов в ядре. Из-за этого взаимодействия для полного разделения ядра на отдельные свободные нуклоны необходимо произвести минимальную работу, которая и определяет энергию связи ядра Есв. Наоборот, при образовании ядра из свободных нуклонов эта энергия выделяется (в виде, например, электромагнитного излучения).
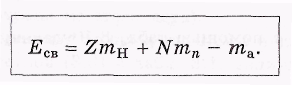
Для упрощения
расчетов вводят понятие дефект
массы
![]() как разность между массой (в а.е.м.) и
массовым числом А
ядра или нуклона:
= m-А.
как разность между массой (в а.е.м.) и
массовым числом А
ядра или нуклона:
= m-А.
где N = А-Z. Соответственно и в таблицах приводят не массы нуклидов, а их дефекты масс.
Удельная энергия связи. Так называют энергию связи, приходящуюся в среднем на один нуклон, т.е. Есв/А. Эта величина характеризует меру прочности ядра: чем больше Есв/А, тем ядро прочнее.
Энергия связи электронов в атомах порядка 10 эВ, что пренебрежимо мало с величиной удельной энергии связи ядра.
Удельная энергии связи Есв/А зависит от массового числа А. График соответствующей зависимости показан на рисунке.
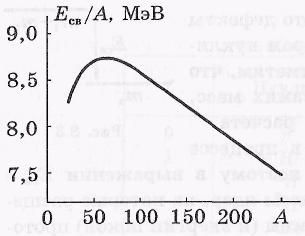
Удельная энергия связи ядер почти не зависит от массового числа А и равна примерно 8 МэВ. Приближенная независимость удельной энергии связи от А означает, что ядерные силы обладают свойством насыщения. Оно заключается в том, что каждый нуклон взаимо-действует только с ограниченным числом соседних нуклонов.
Отсюда также следует, что ядерные силы являются короткодействующими с радиусом порядка среднего расстояния между нуклонами в ядре (~10-13 см).
Наиболее прочными являются ядра с массовыми числами А~ 50÷60, т. е. элементов от Сг до Zn.
