
- •Исторические этапы развития спектральных методов анализа.
- •История. 1800г. – Гершель изучал ик часть спектра. 1801г. – Риттер, уф часть спектра. 1802г. – Волостер обнаружил темные линии в спектре солнца и линейчатый спектр светящихся газов.
- •2. Классификация спектральных методов исследования
- •3 Оборудование спектральных методов исследования
- •4. Какая область спектра электромагнитного излучения используется в спектрометрических методах исследования?
- •5. Какие методы бх исследований относятся к атомной спектрометрии?
- •6. Закон бугера-ламберта-бера.
- •7. Спектральный анализ и его применение
- •8.Методы молекулярной спектрометрии.
- •9. Физический смысл и особенности оптической спектроскопии.
- •10. В чем заключается процесс «атомизации».
- •11. Схема возникновения аналитических сигналов при атомной спектрометрии.
- •12. Какие линии называют «резонансными».
- •13. Пределы обнаружения при атомно-эмиссионном и атомно-абсорбционном методах анализа.
- •14. Различия методов атомной абсорбции и атомной эмиссии.
- •17. Какую функцию выполняет монохроматор
- •18. Устройство «горелки» индуктивно-связанной аргоновой плазмы при исп-асэ
- •19. Атомно-эмиссионная фотометрия пламени: особенности используемого горючего газа, применение.
- •20.Особенности атомно-абсорбционной спектрофотометрии, прмименение.
- •21. Чем отличаются рентгеновский эмиссионный и флуоресцентный методы анализа.
- •22. На чем основаны радиометрические методы анализа. Разновидности,применение.
- •24. Принцип радиометрического метода.
- •26. На чем основан спектрофотометрический анализ.
- •27. Особенности фотометрического и фототурбидиметрического титрования.
- •28.Особенности и применение флуориметрических методов анализа.
- •29. Инфракрасная спектроскопия: особенности, принцип метода, применение.
- •30. Особенности уф спектроскопии биополимеров.
- •31. Классы хромофоров биологических полимеров.
- •Особенности поглощения аминокислотных остатков
- •33. Поглощение простетических групп в белках
- •Проявление вторичной структуры белков в уф спектрах
- •35 Уф спектры нуклеиновых кислот
- •36. Принцип устройства прибора для уф-спектроскопии и методы анализа.
- •37. Особенности ик спектроскопии.
- •38 . Принцип спектрометрии магнитного резонанса
- •Ларморовская прецессия
- •Методика измерения
- •39 . Применение спектроскопии ямр.
- •40. Электронный парамагнитный резонанс Cуть метода
- •Значение метода
- •46. Ионизация молекул
- •47. Методы регистрации ионных токов
- •50. Применение масс-спектрометрии
33. Поглощение простетических групп в белках
Излучение могут поглощать содержащиеся в молекулах некоторых белков простетические группы (см. рис. 2.3.6). Так, например, гемы, флавины, пиридоксальфосфат и некоторые металлопротеиды обладают интенсивными полосами поглощения в ближней УФ- и видимой областях. По этим полосам, обычно весьма чувствительным к ближайшему окружению простетических групп, можно следить за их состоянием, например за окислением или оксигенацией. Такие хромофоры являются весьма полезными при исследовании многих ферментативных реакций.
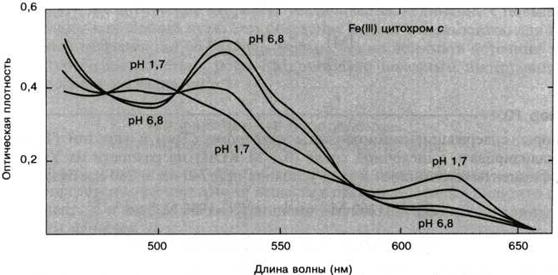
Рис.2.3.6 Спектры поглощения цитохрома с (Fe3+) при различных значениях рН 1.7 – 6.8. Изобестические точки 477, 509 и 584 нм.
С другой стороны, присутствие в белках простетических групп создает и определенные трудности. Почти все хромофоры, которые поглощают в ближней УФ- или видимой областях, имеют столь же интенсивные переходы в интервале от 200 до 300 нм. Если такие хромофоры содержатся в белке в большом количестве, они могут сильно мешать исследованию собственно полипептида. Обойти эту трудность можно, используя апобелки, т.е. белки лишенные простетической группы. Однако при этом нужно быть уверенным, что подобная процедура не искажает структуру полипептидной цепи. Для этого редко бывает достаточно прямых оптических измерений. Если сумма спектров изолированной простетической группы и апобелка совпадает со спектром нативного холобелка, это можно принять как аргумент. Однако, как правило, подобной аддитивности не наблюдается по вполне очевидным причинам (здесь аддитивность скорее исключение из правила, чем правило). Даже в отсутствие конформационных изменений спектры как простетической групппы, так и белка изменяются под действием электронных взаимодействий.
Проявление вторичной структуры белков в уф спектрах
Когда пептидные цепи формируются в упорядоченные структуры (например, спираль) возникает вторичная структура белка. Появление таких структур можно выявить методом УФ спектроскопии. Так, например, на рис. 2.3.1 показано влияние рН и температуры на вид спектра поли-L-лизина. При повышение величины рН (при постоянной температуре) количество положительных зарядов на боковых цепях лизина уменьшается. Это способствует укладке полипептидной цепи в более упорядоченную структуру (спираль). В УФ спектре такая перестройка вторичной структуры (от статистического клубка к спирали) проявляется гипохромным эффектом. Повышение температуры при постоянном рН преобразует спиральную структуру полипептида в β-структуру складчатого типа. Эта перестройка проявляется гиперхромным эффектом. Белки обычно содержат одновременно несколько элементов вторичной структуры в различных положениях пептидной цепи. Процесс денатурации уничтожает значительную часть этих вторичных структур, и как следствие мы имеем изменения в спектрах поглощения. Особенности поглощения, связанные с α-спиралью, β-складчатой структурой или произвольным скручиванием достаточно отчетливы, чтобы можно было использовать их для диагностических целей в случае природного белка, однако здесь более информативными могут быть спектры кругового дихроизма.
