
- •Исторические этапы развития спектральных методов анализа.
- •История. 1800г. – Гершель изучал ик часть спектра. 1801г. – Риттер, уф часть спектра. 1802г. – Волостер обнаружил темные линии в спектре солнца и линейчатый спектр светящихся газов.
- •2. Классификация спектральных методов исследования
- •3 Оборудование спектральных методов исследования
- •4. Какая область спектра электромагнитного излучения используется в спектрометрических методах исследования?
- •5. Какие методы бх исследований относятся к атомной спектрометрии?
- •6. Закон бугера-ламберта-бера.
- •7. Спектральный анализ и его применение
- •8.Методы молекулярной спектрометрии.
- •9. Физический смысл и особенности оптической спектроскопии.
- •10. В чем заключается процесс «атомизации».
- •11. Схема возникновения аналитических сигналов при атомной спектрометрии.
- •12. Какие линии называют «резонансными».
- •13. Пределы обнаружения при атомно-эмиссионном и атомно-абсорбционном методах анализа.
- •14. Различия методов атомной абсорбции и атомной эмиссии.
- •17. Какую функцию выполняет монохроматор
- •18. Устройство «горелки» индуктивно-связанной аргоновой плазмы при исп-асэ
- •19. Атомно-эмиссионная фотометрия пламени: особенности используемого горючего газа, применение.
- •20.Особенности атомно-абсорбционной спектрофотометрии, прмименение.
- •21. Чем отличаются рентгеновский эмиссионный и флуоресцентный методы анализа.
- •22. На чем основаны радиометрические методы анализа. Разновидности,применение.
- •24. Принцип радиометрического метода.
- •26. На чем основан спектрофотометрический анализ.
- •27. Особенности фотометрического и фототурбидиметрического титрования.
- •28.Особенности и применение флуориметрических методов анализа.
- •29. Инфракрасная спектроскопия: особенности, принцип метода, применение.
- •30. Особенности уф спектроскопии биополимеров.
- •31. Классы хромофоров биологических полимеров.
- •Особенности поглощения аминокислотных остатков
- •33. Поглощение простетических групп в белках
- •Проявление вторичной структуры белков в уф спектрах
- •35 Уф спектры нуклеиновых кислот
- •36. Принцип устройства прибора для уф-спектроскопии и методы анализа.
- •37. Особенности ик спектроскопии.
- •38 . Принцип спектрометрии магнитного резонанса
- •Ларморовская прецессия
- •Методика измерения
- •39 . Применение спектроскопии ямр.
- •40. Электронный парамагнитный резонанс Cуть метода
- •Значение метода
- •46. Ионизация молекул
- •47. Методы регистрации ионных токов
- •50. Применение масс-спектрометрии
30. Особенности уф спектроскопии биополимеров.
Одна из особенностей спектроскопии биополимеров состоит в необходимости работать с растворами, поскольку изучение таких больших молекул в газовой фазе невозможно. Спектральные исследования в твердой фазе осложняются дихроичными эффектами. Для подавляющего большинства белков и нуклеиновых кислот наиболее пригодными для имитации условий in vivo растворителями являются водные буферные растворы при рН = 7,0, содержащие достаточные количества электролитов (например, ~ 0,15 М NaCl). Использование воды в качестве растворителя автоматически ограничивает спектральные измерения областью длин волн, больших чем 170 нм. Ниже этого предельного значения поглощение даже очень тонких (~ 1 мкм) водных пленок столь велико, что регистрация на его фоне вклада от макромолекул практически невозможна. Из-за высокой полярности воды электронные полосы поглощения оказываются заметно шире, чем для большинства других растворителей.
Другая трудность связана с узостью температурного интервала, в котором белки и нуклеиновые кислоты сохраняются в нативном виде, т.е. не денатурируют. Кроме того, и сама вода существует в жидком состоянии в достаточно ограниченном диапазоне 0 – 100oС. Для белков и нуклеиновых кислот это не столь важно (денатурация наступает в еще более узком диапазоне), но для модельных соединений и экспериментов невозможность проводить измерения ниже 0oС и выше 100oС оказывается подчас весьма нежелательным обстоятельством.
31. Классы хромофоров биологических полимеров.
Хромофоры белковых молекул удобно разделить на три класса - это:
пептидные группы,
боковые группы аминокислотных остатков,
простетические группы.
Для изучения свойств пептидных хромофоров можно использовать модельные соединения, такие, как формамид или N -метил ацетамид:
К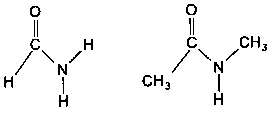 ак
известно, электроны пептидной группы
в известной мере делокализованы по трем
атомам: азоту, углероду и кислороду.
Среди наблюдаемых в пептидной группе
переходов наименьшую энергию имеет n
→ π*-переход. Как и в случае
формальдегида, n-электрон локализован
на атоме кислорода, и этот переход
запрещен по симметрии.
ак
известно, электроны пептидной группы
в известной мере делокализованы по трем
атомам: азоту, углероду и кислороду.
Среди наблюдаемых в пептидной группе
переходов наименьшую энергию имеет n
→ π*-переход. Как и в случае
формальдегида, n-электрон локализован
на атоме кислорода, и этот переход
запрещен по симметрии.
Хромофорные белки. Многие белки содержат группы, отличающиеся от обычных аминокислот. Часто, но не всегда, эти группы связаны ковалентными связями с полипептидной цепью. Вот некоторые примеры присоединенных групп: гликопротеины (сахара), гемпротеины (железосодержащие порфирины), флавопротеины (флавины), родопсин (ретиналь; витамин А). В последних трех случаях группа является хромоформом и вносит вклад в спектр поглощения в видимой или ближней УФ области.
Родопсин широко распространен в природе в позвоночных и беспозвоночных животных. Родопсин состоит из бесцветного белка (или гликопротеина), опсина, к которому ковалентно присоединена хромофорная оболочка (ретиналь). У млекопитающих изомер 11-цис-ретиналя присоединяется к ε-аминогруппе лизиновой боковой цепи опсина при помощи протонированного основания Шиффа:
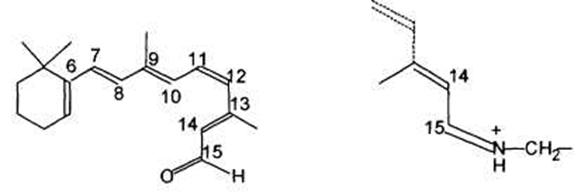
11-цис-ретиналь Основание Шиффа
Ретиналь — это пример линейных полиенов, которые мы рассмотрели ранее. Шесть сопряженных двойных связей альдегида содержат π-электроны. В результате сопряжения здесь наблюдается значительный батохромный сдвиг π → π* - перехода, что и обуславливает окраску этого хромофора.
Излучение могут поглощать содержащиеся в молекулах некоторых белков простетические группы (см. рис. 2.3.6). Так, например, гемы, флавины, пиридоксальфосфат и некоторые металлопротеиды обладают интенсивными полосами поглощения в ближней УФ- и видимой областях. По этим полосам, обычно весьма чувствительным к ближайшему окружению простетических групп, можно следить за их состоянием, например за окислением или оксигенацией. Такие хромофоры являются весьма полезными при исследовании многих ферментативных
