
Процессы формирования структуры вещества.
По степени упорядоченности структура вещества подразделяется на кристаллическую (с дальним порядком) и аморфную (с ближним порядком). В аморфных телах только расположение соседей является строго определенным, соответствующим основному типу связи между атомами. Поэтому и говорят о ближнем порядке.
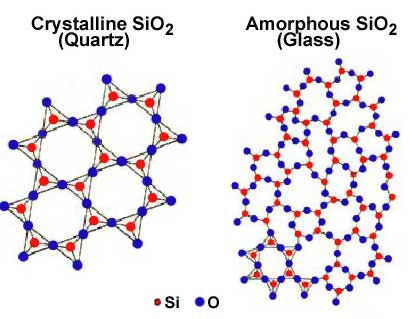
Рис. Кристаллическая (кварц) и аморфная (стекло) структуры оксида кремния.
Упорядоченная структура с дальним порядком получается в результате кристаллизации, аморфная структура с ближним порядком – в результате стеклования.
Кристаллизация.
Этапы кристаллизации: 1) - образование зародыша (центра кристаллизации),
2) - рост зародыша, 3) - срастание зародышей.
Этап 1. Образование зародыша. Энергетическое состояние некоторого объема вещества как системы частиц характеризуется свободной энергией Есв. Свободная энергия зависит от температуры и различна для жидкой и твердой фаз вещества. Чем больше свободная энергия Есв, тем менее устойчива система. В соответствии с аксиомой максимальной устойчивости при минимуме энергии система переходит в то состояние, где Есв меньше.


 Есв
Кристалл Рис.
Изменение свободной энергии
Есв
Кристалл Рис.
Изменение свободной энергии
 в
зависимости от температуры.
в
зависимости от температуры.
Тпл - равновесная или теорети-
Жидкость ческая температура
кристаллизации.
Тпл Т
Етв < Еж Етв=Еж Етв > Еж
Е*=Етв- Еж <0 =0 >0
При температуре, меньшей Тпл, свободная энергия твердого тела (Етв) меньше свободной энергии жидкости ( Еж ), поэтому пойдет процесс кристаллизации. Если в твердом теле расстояние устойчивого равновесия ro меньше, то объем вещества уменьшается.
Потенциальная энергия взаимосвязи в кристалле больше (меньше по абсолютной величине), чем в жидком состоянии, поэтому при кристаллизации начинает выделяться энергия - т.н. “скрытая теплота”. Эта энергия мешает кристаллизации. Для поддержания процесса кристаллизации необходимо переохлаждать вещество.
Степень переохлаждения Т: Т = Тпл - Тп.
Тп - реальная температура (переохлаждения), при которой начинается кристаллизация.



 Т
Рис.
Изменение температуры во время
Т
Рис.
Изменение температуры во время
кристаллизации.
Тпл
Тп
t,сек
Этап 2. Рост зародыша. В процессе кристаллизации в веществе имеются 2 фазы: жидкая и твердая. Между ними - поверхность раздела с коэффициентом поверхностного натяжения .
(Внутри фазы силы притяжения и отталкивания между молекулами взаимно компенсируются. На молекулы вблизи поверхности действует нескомпенсированная результирующая сила, направленная внутрь. Для перемещения молекулы из глубины к поверхности необходимо совершить работу против результирующей силы. Молекулы на поверхности обладают определенной потенциальной энергией, называемой поверхностной энергией Еs. Если не действует внешняя сила, то поверхностная энергия минимальна и площадь поверхности S минимальна.
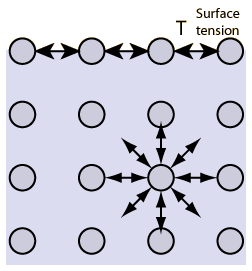
Рис. Поверхностное натяжение.
Поверхностным натяжением называют отношение работы Еs, требующейся для увеличения площади поверхности на S, к величине этой площади S: = Еs / S). Свойства фазы вещества вблизи поверхности раздела отличаются от ее свойств в объеме.
На образование поверхности раздела фаз площадью S требуется затрата энергии Еs:
Еs = S , Еs 0.
Разность свободных энергий Есв твердого и жидкого состояний, приходящаяся на единицу объема (удельная характеристика):
Е* = Етв - Еж.
Е* зависит от соотношения температур Тпл и Тп. При переходе из жидкого состояния в твердое вещества (зародыша) объемом V изменение свободной энергии будет
Еv = Е* V .
Суммарное изменение свободной энергии при появлении в жидкости зародыша объемом V и площадью поверхности S:
Есв = Еv + Еs = - Е* V + S .
Процесс кристаллизации может протекать только при уменьшении Есв. Поскольку Еs>0, то Еv должно скомпенсировать увеличение Еs для того, чтобы началась кристаллизация.
Из-за неоднородного распределения температуры внутри вещества образуются зародыши в точках с наименьшей температурой. Зародыши имеют разные размеры. Для сферического зародыша в системе из n частиц Есв будет:
(V = 4/3 r 3 , S = 4 r2 ) , Есв = - Е* (4/3) r3 + 4 r2 .





Есв Т1 Рис. Зависимость критического
радиуса от температуры
переохлаждения Т.
Т2 ( Т1 Т2 Т3 Т4)
 Т3
Т3
r
r4 r3 Т4
- Есв
Зародыши с радиусом меньше критического ( rкр ) расти не могут. Им мешает выделение “скрытого тепла”. Зародыши расплавляются. При rrкр зародыши начинают расти. Чем больше переохлаждение, тем меньше может быть критический радиус rкр и тем быстрее протекает процесс кристаллизации.
Для определения критического радиуса выявим условия максимума, продифференцировав выражение для Есв:
d (Есв)/ dr = - Е* 4/3 3 rкр2 + 4 2 rкр = 0, rкр = 2 / Е*.
Этап 3. Срастание зародышей. Внутри зародыша частицы соединяются между собой, как правило, путем перестройки электронных оболочек атомов при их сближении. В этом участвуют все типы связи. Внутри зародыша имеет место дальний порядок. Поверхность раздела отличается по структуре, имеет большую Есв и, часто, свободные радикалы.
Зародыши, разрастаясь, сближают поверхности разделов. Ближайшие друг к другу атомы и молекулы этих поверхностей также соединяются между собой, но нарушается регулярность структуры. Границы зерен отчетливо видны на шлифах образцов. Вся внешняя поверхность закристаллизованного вещества, внутренние границы зерен и дефектные микрообъемы обладают повышенной Есв .
Рекристаллизация.
При температуре кристалла, большей 0,25 Тпл, начинается процесс рекристаллизации, т.е. переструктурирования вещества.
При нагревании разрушаются прежде всего связи элементов в микрообъемах с большей Есв (меньшей потенциальной) энергией. При остывании эти микрообласти кристаллизуются. Увеличивается общее число зерен. Нагревание, практически, не затрагивает области с регулярной структурой. Возрастает поликристалличность.
Различие процессов кристаллизации и рекристаллизации.
Кристаллизация |
Рекристаллизация |
Принудительное охлаждение |
Принудительное нагревание |
места с минимальными Есв и температурой
Т
|
места с максимальными Есв и температурой
Т |
Энергия, выделяющаяся при кристаллизации: “скрытая теплота” мешает, требует увеличения степени переохлаждения |
помогает - увеличивает область кристаллизации |
Объемные и пленочные кристаллические структуры.
Некоторые свойства объемных и пленочных кристаллов различаются. Причинами этого являются:
1 - методы изготовления (величина внешней энергии, плотность получающейся структуры, особенности рельефа),
2 - соотношение площади границы фаз S и объема вещества V ( S\V).
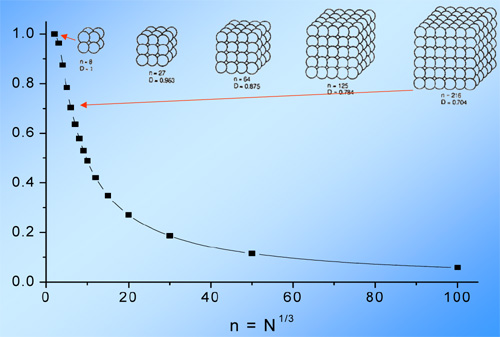
Рис. Доля поверхностных атомов (молекул).
Методы изготовления определяют плотность и однородность структуры. Наибольшая плотность получается при кристаллизации из расплава. Так чаще получают объемные образцы. При изготовлении пленок используются методы осаждения из газовой фазы, химическое и электрохимическое осаждение, распыление, спекание твердых частиц. Концентрация вещества при этих методах ниже. В очень тонких пленках ( до 0,1мкм ) по толщине умещается один зародыш, поэтому сильно ощущается неоднородность структуры (само зерно и его границы имеют различные свойства). В объеме эти эффекты усредняются.
Соотношение S\V на несколько порядков больше у пленки. Поскольку потенциальная энергия связи частиц поверхности раздела фаз меньше, чем в объеме, меньше и усредненная потенциальная энергия пленочного образца и меньше зависящие от нее характеристики, например, температура плавления. Еще большее различие наблюдается у наноструктур.
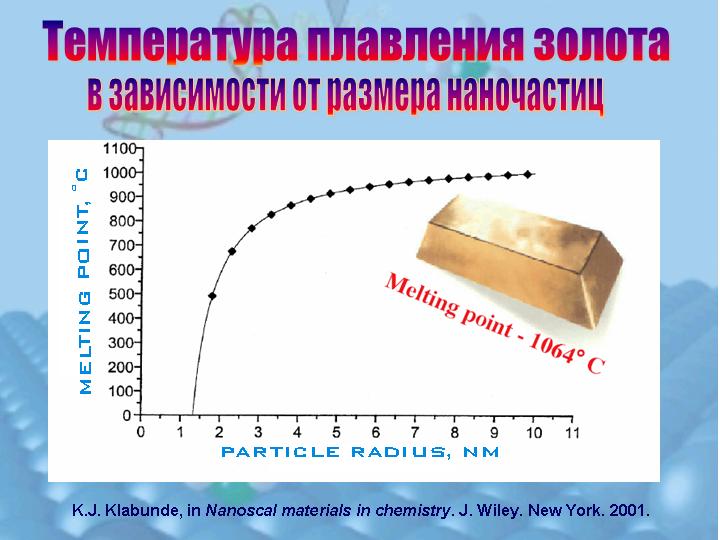
Рис. Зависимость температуры плавления золота от размера нанообъекта.
Малая толщина пленки не обеспечивает достаточной механической прочности, поэтому требуется подложка, свойства которой, как правило, отличаются. Это приводит к существенным деформациям усадки и термической, появлению дефектов структуры и, следовательно, ускоренному протеканию процессов старения, рекристаллизации, диффузии. Большую роль играет адгезия - сцепление молекул 2-х разных материалов.
Стеклование
Колебательная составляющая движения частицы относительно положения равновесия характеризуется периодом 0 , а дрейфовая - средним временем “оседлой жизни” в положении равновесия . Из положения равновесия частицу выводит энергия теплового движения Еакт - энергия активации
= о exp ( Eакт / ( kT)),
где к – постоянная Больцмана, Т – температура. Величина exp ( - Eакт / ( k T )) представляет собой вероятность приобретения молекулой энергии, достаточной для преодоления потенциального барьера и перехода в новое положение равновесия. Потенциальный барьер создается соседними молекулами.
В жидком состоянии Еакт существенно меньше, чем в твердом, поэтому дрейф в жидкости больше. Это предопределяет основное свойство жидкости - текучесть, которая количественно выражается вязкостью .
Фазовое состояние |
о, с |
, с |
Жидкость (расплавленный металл) |
10-13 |
10-10 |
Твердый металл |
10-13 |
10 5 (1 раз за несколько суток) |
Кристаллические тела обладают большой вязкостью или малой текучестью, проявляющейся как пластическая деформация. Вязкость или явление внутреннего трения связано с силами трения между слоями, перемещающимися параллельно друг другу с разными скоростями. Силы трения являются следствием сил взаимодействия между частицами.
При высокой температуре в жидкости постоянно происходит перегруппировка. Время установления в системе нового положения равновесия называется временем релаксации. Среднее для системы время релаксации приблизительно равно времени “оседлой жизни”:
.
Для многих жидкостей (расплавленный металл) время релаксации остается небольшим вплоть до температуры кристаллизации Тs . У некоторых веществ и в жидком состоянии устанавливается сильное взаимодействие: при увеличении энергии активации Еакт растет вязкость и время релаксации . При охлаждении вязкость увеличивается еще больше. При снижении температуры это практически предотвращает перестройку внутренней структуры в более упорядоченное состояние в “обозримое” время. В результате расплав при охлаждении не меняет внутреннюю структуру. Такое твердообразное (стеклообразное) состояние иногда называют переохлажденной жидкостью.
В кристаллах мало изменяется расстояние между частицами (термодинамическое равновесие). В жидкости происходит непрерывная перестройка внутренней структуры, следовательно, нельзя говорить о стабильности. Аморфную фазу называют метастабильной, неравновесной.
При охлаждении жидкости возможно получение кристаллической (с дальним порядком) или аморфной (с ближним порядком) структуры. Результат зависит от
- вязкости жидкости вблизи температуры отверждения.
- скорости охлаждения,
- наличия центров кристаллизации.
Кристаллическая структура получается при малой вязкости, относительно медленном охлаждении, наличии центров кристаллизации. При кристаллизации происходит фазовый переход при определенной температуре, объем резко уменьшается.

 В
отсутствии центров кристаллизации и
быстром охлаждении жидкость может быть
охлаждена ниже температуры кристаллизации
Тs
- стать переохлажденной (метастабильное
состояние). Изменение структуры “отстает”
от изменения температуры: атомы и
молекулы не успевают перестроиться в
упаковку, более эффективную с энергетической
точки зрения. Структура перестает быть
равновесной. Происходит процесс
стеклования.
В
отсутствии центров кристаллизации и
быстром охлаждении жидкость может быть
охлаждена ниже температуры кристаллизации
Тs
- стать переохлажденной (метастабильное
состояние). Изменение структуры “отстает”
от изменения температуры: атомы и
молекулы не успевают перестроиться в
упаковку, более эффективную с энергетической
точки зрения. Структура перестает быть
равновесной. Происходит процесс
стеклования.
V
a
 f
f
g - велико
 -
мало b
-
мало b
 с
` g΄
e
с
` g΄
e
d b΄
 T1
Tcт
Ts
T
T1
Tcт
Ts
T
При переохлаждении до температуры Т1 происходит нелинейное уменьшение объема, а ниже температуры Т1 - линейное. Интервал температур от Тs до Т1 является областью отверждения - стеклования. Температура стеклования Тст условно определяется как точка пересечения касательных в области стыка линейной и нелинейной части зависимости V = f ( T ). (Для кристаллических структур отверждение происходит при одной и той же температуре Тs . При большой скорости охлаждения можно получить аморфный металл.) От скорости охлаждения жидкости в интервале стеклования зависят свойства аморфного твердого тела - стекла. Так температура размягчения стекла зависит от “тепловой предыстории”.
Соблюдение лишь ближнего порядка обусловливает меньшую плотность аморфных тел, а также большое число разорванных связей, дефектов, большую величину свободной энергии Есв. Избыток свободной энергии в неравновесном состоянии предопределяет возможность упорядочивания внутренней структуры. Процесс упорядочивания для стекла может длиться веками, для резины - годами. Тонкая пленка аморфной сурьмы может существовать долго, но при превышении некоторой критической толщины переход в кристаллическое состояние происходит взрывообразно.
Неупорядоченность внутренней структуры обусловливает изотропность свойств аморфных тел. Можно добиться анизотропности отдельных свойств при проведении стеклования в электрических или магнитных полях.
При высокой температуре в стекле могут растворяться разного рода добавки. Они изменяют температуру стеклования Тст. При этом меняется структура стекла (степень упорядоченности) и его свойства. Это расширяет возможности синтезировать аморфные материалы с заранее заданными свойствами.
Для подложек используют сочетание кристаллических и аморфных свойств твердых тел. Керамика большей частью содержит кристаллы (корунда, рутила, кристоболида,...) и несколько % стекла. В ситаллах стекла кристаллизуют путем введения добавок, способных образовывать зародыши кристаллитов. Аморфное стекло и в керамике и в ситаллах служат для связки кристаллитов.
Аморфные металлические сплавы получают осаждении при очень быстром охлаждении (1000ºС/с) жидкого металла на быстро вращающийся диск. Используются в качестве информационной среды при термомагнитной записи. Из-за отсутствия границ зерен уменьшаются шумы при считывании информации. Композитные пленки: Tb – Fe, Tb – Fe - Co, - используются в качестве магнито – оптического носителя для реверсивной лазерной записи.
Условия |
Кристаллизации |
Стеклования |
Вязкость жидкости вблизи температуры отверждения |
Малая |
Большая |
Скорость |
Малая |
Большая |
Центры кристаллизации |
Есть |
нет |
Сравнение свойств кристаллического и аморфного вещества.
Параметр |
Кристаллического вещества |
Аморфного вещества |
Энергия связи |
Больше |
Меньше |
Устойчивость структуры |
Термодинамическое равновесие |
Метастабильность |
Температура отверждения |
Постоянна |
В интервале |
Дефектность |
Меньше |
Больше |
Свободная энергия |
Меньше |
Больше |
Плотность, вес |
Больше |
Меньше |
Анизотропия |
Ярко выражена |
Слабо выражена |
Управляемость свойствами |
Соотношением компонентов |
Введением модификаторов |









 Начало:
Начало: