
- •15 Динамика механика
- •Глава 1. Кинематика
- •1.1. Закон движения материальной точки
- •1.2. Скорость определяет быстроту движения.
- •Чтобы определить скорость изменения функции, надо взять производную этой функции по времени.
- •1.3. Ускорение
- •1.4. Кинематика вращательного движения
- •Глава 2. Динамика
- •2.1.Первый закон Ньютона (закон инерции)
- •2.2. Второй закон Ньютона
- •Изменение импульса (количества движения) за время равно импульсу силы за это же время.
- •2.3. Третий закон Ньютона
- •2.4. Сохраняющиеся величины
- •2.5. Основной закон динамики для системы материальных точек. Закон сохранения импульса.
- •Скорость изменения импульса системы материальных точек равна векторной сумме внешних сил.
- •2.6. Центр инерции
- •Глава 3. Работа и энергия
- •3.1.Работа силы и ее выражение через криволинейный интеграл
- •3.2.Мощность
- •3.3. Кинетическая энергия
- •3.4. Потенциальная энергия
- •3.5. Потенциальные кривые
- •3.6.Закон сохранения механической энергии
- •3.7. Соударения
- •Глава 4. Механика вращательного движения
- •4.1. Кинетическая энергия вращательного движения. Момент инерции.
- •4.3. Второй закон Ньютона вращательного движения.
- •4.4. Момент импульса. Закон сохранения момента импульса.
- •4.5. Таблица соответствия поступательного и вращательного движений
- •Работа и энергия
- •Глава 5 механические колебания и волны
- •5.1.Основные понятия
- •5.2.Дифференциальное уравнение свободных гармонических колебаний
- •5.3. Примеры свободных гармонических колебаний
- •5.4. Затухающие колебания.
- •5.5. Вынужденные колебания
- •5.6. Автоколебания.
- •5.7.Сложение колебаний.
- •Глава 6. Механические (упругие ) волны. Звук
- •6.1. Характеристики упругих волн
- •6.2. Уравнение бегущей волны
- •Основы молекулярной физики и термодинамики
- •Глава 7. Основы молекулярно–кинетической теории
- •7.1. Основные понятия и определения
- •7.2. Уравнение состояния идеального газа
- •7.3. Основное уравнение молекулярно–кинетической теории идеального газа (основное уравнение мкт)
- •Абсолютная температура является мерой средней кинетической энергии поступательного движения молекулы.
- •7.4. Закон распределения молекул по скоростям
- •7.5. Барометрическая формула #
- •Глава 8 основы термодинамики
- •8.1. Первый закон термодинамики
- •6.2. Простейшие процессы в идеальных газах
- •8.3. Второй закон термодинамики
- •8.4. Цикл Карно
- •Глава 9 реальные газы
- •9.1. Уравнение состояния реальных газов (уравнение Ван–дер–Ваальса).
- •9.2.Изотермы реальных газов
9.2.Изотермы реальных газов
Рис.
9.2.1
Рис.
9.2.2
Изотермы идеальных газов (рис.9.2.1).были получены в § 6.2. Газ находиться в контакте с термостатом, обеспечивающим постоянство температуры (рис.9.2.2). При сжатии газа объем уменьшается обратно пропорционально давлению.
Рис.
9.2.3

На рисунке 9.2.3. приведены шесть экспериментальных изотерм реальных газов
![]() .
.
1.
Если
![]() —изотерма близка к изотерме идеального
газа;
—изотерма близка к изотерме идеального
газа;
2.
Если
![]() на изотерме появляется горизонтальный
участок, например
на изотерме появляется горизонтальный
участок, например
![]() ,
на котором сжатие не сопровождается
изменением давления. Работа внешней
силы идет на изменение потенциальной
части внутренней энергии, при этом
изменяется фазовое состояние вещества,
происходит фазовый переход: вещество
из фазы газа конденсируется в фазу
жидкости. В области
,
на котором сжатие не сопровождается
изменением давления. Работа внешней
силы идет на изменение потенциальной
части внутренней энергии, при этом
изменяется фазовое состояние вещества,
происходит фазовый переход: вещество
из фазы газа конденсируется в фазу
жидкости. В области
![]() существует одновременно и жидкость и
газ (пар). При изотермическом сжатии
точки
и
—
начало и конец конденсации. При
изотермическом расширении точки
— начало кипения,
—
конец кипения.
существует одновременно и жидкость и
газ (пар). При изотермическом сжатии
точки
и
—
начало и конец конденсации. При
изотермическом расширении точки
— начало кипения,
—
конец кипения.
Рис.
9.2.4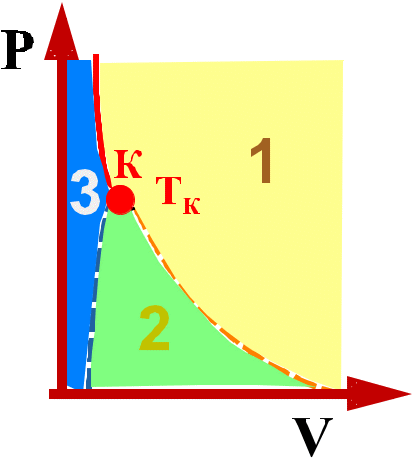
![]() кинетическая энергия молекул так
велика, что силы притяжения не могут
удержать молекулы вместе на какое бы
расстояние мы их не сближали внешним
давлением. Таким
образом, на диаграммах изотерм выделяется
три области (рис 9.2.4):
кинетическая энергия молекул так
велика, что силы притяжения не могут
удержать молекулы вместе на какое бы
расстояние мы их не сближали внешним
давлением. Таким
образом, на диаграммах изотерм выделяется
три области (рис 9.2.4):
1 — область, в которой вещество существует в виде газа;
2 — область фазового перехода: газ (пар) существует одновременно с жидкостью;
3 — область, в которой вещество существует только в виде жидкости.
В
критической точке
с параметрами
![]() теряется различие между газом и
жидкостью.
теряется различие между газом и
жидкостью.
Рис.
9.2.5
На рис.9.2.5 представлены графики изотерм, полученных из уравнения Ван–дер–Ваальса.
Сравнение с
изотермами реальных газов показывает,
что теория хорошо описывает эксперимент
не только в области газообразного
состояния, но также в областях двухфазного
и жидкого состояний. Участок
![]() изотермы
соответствует жидкости, нагретой выше
температуры кипения (перегретой
жидкости),
участок
изотермы
соответствует жидкости, нагретой выше
температуры кипения (перегретой
жидкости),
участок
![]() — соответствует
пересыщенному пару.
Это метастабильные состояния,
действительно реализующиеся в однородной
жидкости или паре. При введении центров
конденсации (кипения) происходит бурный
фазовый переход. Участок изотермы
— соответствует
пересыщенному пару.
Это метастабильные состояния,
действительно реализующиеся в однородной
жидкости или паре. При введении центров
конденсации (кипения) происходит бурный
фазовый переход. Участок изотермы
![]() практически неосуществим.
практически неосуществим.
