
- •15 Динамика механика
- •Глава 1. Кинематика
- •1.1. Закон движения материальной точки
- •1.2. Скорость определяет быстроту движения.
- •Чтобы определить скорость изменения функции, надо взять производную этой функции по времени.
- •1.3. Ускорение
- •1.4. Кинематика вращательного движения
- •Глава 2. Динамика
- •2.1.Первый закон Ньютона (закон инерции)
- •2.2. Второй закон Ньютона
- •Изменение импульса (количества движения) за время равно импульсу силы за это же время.
- •2.3. Третий закон Ньютона
- •2.4. Сохраняющиеся величины
- •2.5. Основной закон динамики для системы материальных точек. Закон сохранения импульса.
- •Скорость изменения импульса системы материальных точек равна векторной сумме внешних сил.
- •2.6. Центр инерции
- •Глава 3. Работа и энергия
- •3.1.Работа силы и ее выражение через криволинейный интеграл
- •3.2.Мощность
- •3.3. Кинетическая энергия
- •3.4. Потенциальная энергия
- •3.5. Потенциальные кривые
- •3.6.Закон сохранения механической энергии
- •3.7. Соударения
- •Глава 4. Механика вращательного движения
- •4.1. Кинетическая энергия вращательного движения. Момент инерции.
- •4.3. Второй закон Ньютона вращательного движения.
- •4.4. Момент импульса. Закон сохранения момента импульса.
- •4.5. Таблица соответствия поступательного и вращательного движений
- •Работа и энергия
- •Глава 5 механические колебания и волны
- •5.1.Основные понятия
- •5.2.Дифференциальное уравнение свободных гармонических колебаний
- •5.3. Примеры свободных гармонических колебаний
- •5.4. Затухающие колебания.
- •5.5. Вынужденные колебания
- •5.6. Автоколебания.
- •5.7.Сложение колебаний.
- •Глава 6. Механические (упругие ) волны. Звук
- •6.1. Характеристики упругих волн
- •6.2. Уравнение бегущей волны
- •Основы молекулярной физики и термодинамики
- •Глава 7. Основы молекулярно–кинетической теории
- •7.1. Основные понятия и определения
- •7.2. Уравнение состояния идеального газа
- •7.3. Основное уравнение молекулярно–кинетической теории идеального газа (основное уравнение мкт)
- •Абсолютная температура является мерой средней кинетической энергии поступательного движения молекулы.
- •7.4. Закон распределения молекул по скоростям
- •7.5. Барометрическая формула #
- •Глава 8 основы термодинамики
- •8.1. Первый закон термодинамики
- •6.2. Простейшие процессы в идеальных газах
- •8.3. Второй закон термодинамики
- •8.4. Цикл Карно
- •Глава 9 реальные газы
- •9.1. Уравнение состояния реальных газов (уравнение Ван–дер–Ваальса).
- •9.2.Изотермы реальных газов
8.4. Цикл Карно
Рис.
8.4.1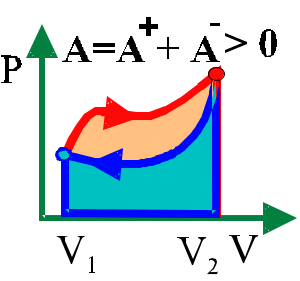

Рис.
8.4.2
Тепловой двигатель превращает внутреннюю энергию топлива в механическую энергию (работу). Примеры: паровой или турбинный двигатель, двигатель внутреннего сгорания, двигатель Дизеля.
Тепловой двигатель состоит из нагревателя (котел, камера сгорания), холодильника (теплообменник, атмосфера) и рабочего тела (газ, пар). В рабочем цикле (рис.8.4.2) протекают следующие процессы:
Рабочее тело получает от нагревателя теплоту Q1 при температуре Т1.
Рабочее тело, расширяясь, совершает работу А1.
Для возвращения в начальное состояние, остаток теплоты Q2 рабочее тело отдает холодильнику при температуре Т2 < Т1.
Внешние силы
доводят температуру и давление рабочего
тела до начальных значений, совершая
над ним работу
![]() .
.
КПД
теплового двигателя
определяется
отношением полезной работы (энергии)
к затраченной. Применяя для рабочего
тела закон сохранения энергии, получаем![]() ,
тогда
,
тогда
![]() .
.
Тепловые двигатели
с обратными циклами называются
холодильниками. Для них
![]() ,
,
![]() и
и
![]() .
Противоестественный ход тепла (от
холодного к горячему) обеспечивается
внешней работой.
.
Противоестественный ход тепла (от
холодного к горячему) обеспечивается
внешней работой.
 Рис. 8.4.3
Рис. 8.4.3
Цикл Карно состоит из двух изотерм (1–1/ , 2–2/) и двух адиабат (1/–2, 2/ –1). Каждый из этих процессов идеален потому, что теплота и изменение внутренней энергии в них полностью превращаются в работу (рис.8.4.3).
Рассмотрим изменение энтропии рабочего тела.
Общее изменение
энтропии в цикле
![]() .
Так как мы рассматриваем только обратимые
процессы, общее изменение энтропии
.
Так как мы рассматриваем только обратимые
процессы, общее изменение энтропии
![]() .
.
![]() —изменение
энтропии при изотермическом расширении
1–1/,
—изменение
энтропии при изотермическом расширении
1–1/,
![]() — адиабатное
расширение
— адиабатное
расширение
![]() с охлаждением до температуры холодильника
,
с охлаждением до температуры холодильника
,
![]() — изотермическое
сжатие в контакте с холодильником
— изотермическое
сжатие в контакте с холодильником
![]() тело отдает теплоту,
тело отдает теплоту,
![]() — адиабатное
сжатие
до начального состояния
— адиабатное
сжатие
до начального состояния
![]() .
.
Общее изменение
![]()
 .
Поэтому,
.
Поэтому,
максимальный
кпд теплового двигателя
—
![]() .
.
Следствия:
КПД цикла Карно не зависит от рода рабочего тела.
КПД определяется только разницей температур нагревателя и холодильника.
КПД не может быть равен 100% даже у идеальной тепловой машины, так как при этом температура холодильника должна быть
 ,
что запрещено законами квантовой
механики.
,
что запрещено законами квантовой
механики.Невозможно создать вечный двигатель второго рода, т.е. двигатель, работающий в тепловом равновесии без перепада температур при
 .
.
Глава 9 реальные газы
9.1. Уравнение состояния реальных газов (уравнение Ван–дер–Ваальса).
Силы межмолекулярного взаимодействия.
а) Молекулы идеального газа (упругие материальные точки) не взаимодействуют друг с другом. Их внутренняя энергия не зависит от расположения молекул и определяется только их кинетической энергией. Такая модель описывает поведение весьма разряженных реальных газов и плохо работает в области больших давлений и фазовых переходов газ—жидкость.
Рис.
9.1.1
![]() диаметров) молекулы отталкиваются, на
расстояниях (
диаметров) молекулы отталкиваются, на
расстояниях (![]() диаметров) — притягиваются, на расстояниях
>9 диаметров
взаимодействием молекул можно пренебречь.
Силы межмолекулярного взаимодействия
имеют электромагнитную квантовую
природу. Примерная зависимость сил
взаимодействия от межмолекулярного
расстояния представлена на верхнем
рисунке 9.1.1.
диаметров) — притягиваются, на расстояниях
>9 диаметров
взаимодействием молекул можно пренебречь.
Силы межмолекулярного взаимодействия
имеют электромагнитную квантовую
природу. Примерная зависимость сил
взаимодействия от межмолекулярного
расстояния представлена на верхнем
рисунке 9.1.1.
 Рис.
9.1.2
Рис.
9.1.2![]() )
от расстояния между ними (
).
Пунктирной линией отмечено
положение равновесия, в котором
потенциальная энергия достигает
минимума.
)
от расстояния между ними (
).
Пунктирной линией отмечено
положение равновесия, в котором
потенциальная энергия достигает
минимума.
Соотношение между потенциальной и кинетической энергией молекулы определяет агрегатное состояние вещества.
![]() — газ,
— газ,
![]() — жидкость,
— жидкость,
![]() — твердое тело.
— твердое тело.
Уравнение состояния реальных газов.
Уравнение состояния
одного моля любого идеального газа
![]() справедливо для газов, в которых можно
пренебречь размерами и взаимодействием
молекул, что подходит для реальных
разряженных газов. Однако, при относительно
больших давлениях и низких температурах
это не так.
справедливо для газов, в которых можно
пренебречь размерами и взаимодействием
молекул, что подходит для реальных
разряженных газов. Однако, при относительно
больших давлениях и низких температурах
это не так.
1.
Учтем конечный объем реальных молекул,
обозначив его
![]() .
.
Тогда свободный
молярный объем уменьшится:
![]() ,
следовательно
,
следовательно
![]() .
Так как, при
.
Так как, при
![]()
![]() ,
,
![]() — собственный объем молекул.
— собственный объем молекул.
2.
Учтем взаимодействие молекул.
За счет
взаимного притяжения молекул давление
на стенки сосуда уменьшится на
![]() :
:
![]() или
или
![]() .
.
О
Рис.
9.1.3
![]() .
Для этого представим объем газа в виде
двух объемов
.
Для этого представим объем газа в виде
двух объемов
Рис. 3.2.3
![]() .
Силы притяжения первой и второй частей
пропорциональны концентрации молекул
в поверхностном слое на левой и правой
поверхности границы раздела, поэтому
.
Силы притяжения первой и второй частей
пропорциональны концентрации молекул
в поверхностном слое на левой и правой
поверхности границы раздела, поэтому
![]() ,
где
,
где
![]() параметр, зависящий только от природы
газа, тогда:
параметр, зависящий только от природы
газа, тогда:
 — Уравнение
Ван–дер–Ваальса.
— Уравнение
Ван–дер–Ваальса.
