
- •Глава 1.Мономеры клетки
- •Неполярные аминокислоты
- •Полярные незаряженные аминокислоты
- •Заряженные аминокислоты
- •1.1.1.Кислотно-основное равновесие в растворе -аминокислот
- •1.1.2.Некоторые химические свойства -аминокислот
- •1.2.Моносахариды
- •1.3.Нуклеозиды и нуклеотиды
- •1.3.1.Строение и номенклатура
- •1.3.2.Свойства нуклеозидов и нуклеотидов
- •1.3.3.Конформация нуклеозидов и нуклеотидов
- •1.4.Липиды
- •1.4.1.Химическое строение липидов
- •1.4.2.Фосфолипиды
- •1.4.3.Стероиды
1.3.Нуклеозиды и нуклеотиды
1.3.1.Строение и номенклатура
В нуклеиновых кислотах встречаются, в основном, пять нуклеиновых оснований, три пиримидиновых — урацил, тимин и цитозин и два пуриновых — аденин и гуанин (Рис. 2 .5).
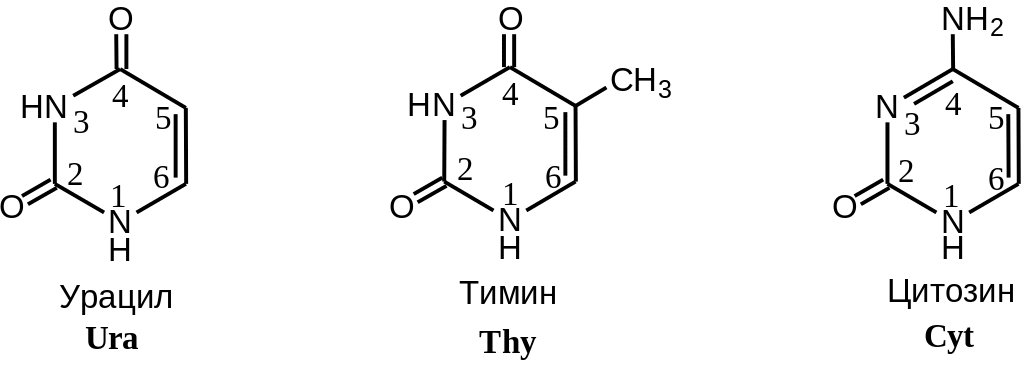

Рис. 2.13. Строение нуклеиновых оснований
Нуклеозиды (Рис. 2 .14) представляют собой гликозиды, в которых либо D‑рибофураноза (в рибонуклеозидах), либо 2-дезокси-D-рибофураноза (в 2‑дезоксирибонук-леозидах) связана гликозидной связью с атомом N1 пиримидиновых или атомом N9 пуриновых оснований. Все природные нуклеозиды (и рибо, и 2-дезокси) являются ‑аномерами.
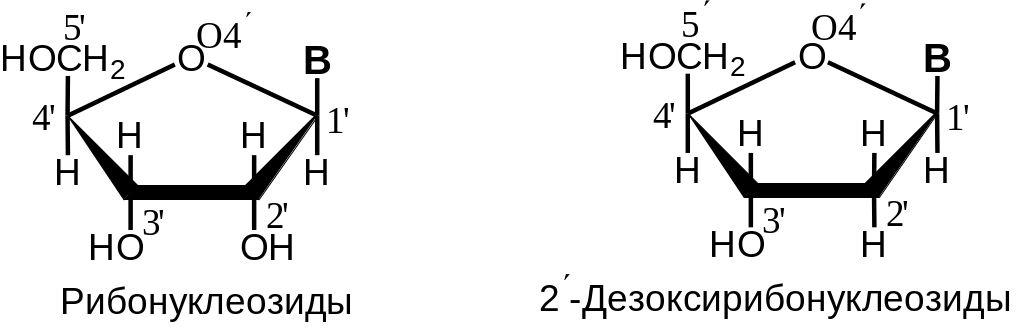
В = Урацил: Уридин (Urd) 2-Дезоксиуридин (dUrd)
B = Тимин: Риботимидин (rThd) Тимдин (Thd)
B = Цитозин: Цитидин (Cyd) 2-Дезоксицитидин (dCyd)
B = Аденин: Аденозин (Ado) 2-Дезоксиаденозин (dAdo)
B = Гуанин: Гуанозин (Guo) 2-Дезоксигуанозин (dGuo)
Рис. 2.14. Структурные формулы нуклеозидов. Чтобы отличить атомы углеводного остатка от атомов нуклеинового основания, их нумеруют цифрами со штрихом
Рибонуклеозиды входят в состав рибонуклеиновых кислот (РНК), а 2‑дезоксирибонуклеозиды — в состав дезоксирибонуклеиновых кислот (ДНК).
Нуклеотиды являются фосфорными эфирами нуклеозидов. Фосфорная кислота присоединена к одному из гидроксилов рибозного (2-дезоксирибозного) остатка. В зависимости от места присоединения различают 2-, 3- и 5-нуклеозиды. Мононуклеотиды представляют собой эфиры ортофосфорной кислоты и, следовательно, содержат один атом фосфора на молекулу (Рис. 2 .15).
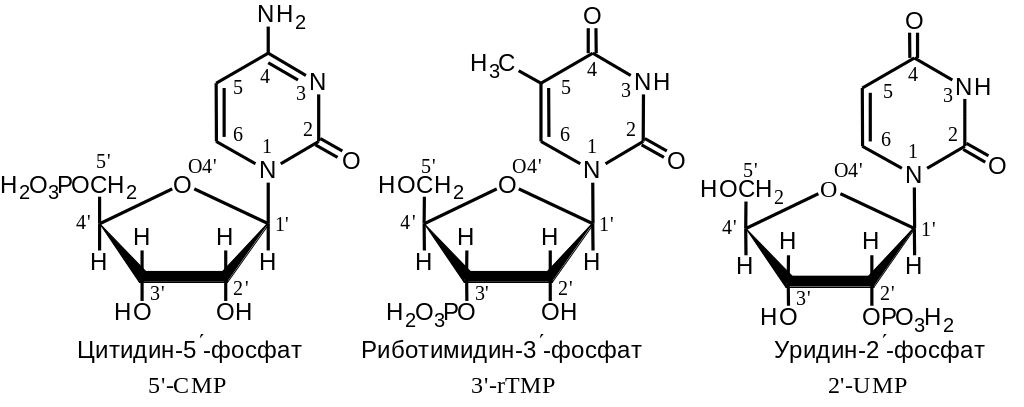


Рис. 2.15. Строение некоторых мононуклеотидов. Сокращенные названия мононуклеотидов включают однобуквенный код нуклеозида и буквы MP (MonoPhosphate). Перед названием ставят цифру, указывающую место присоединения фосфорного остатка
Большинство обычных мононуклеотидов являются моноэфирами фосфорной кислоты. Реже встречаются циклические диэфиры: нуклеозид-3,5-циклофосфаты и нуклеозид-2, 3-циклофосфаты (Рис. 2 .16).

Рис. 2.16. Строение некоторых циклических фосфатов
В природе широко распространены моно- и диэфиры пирофосфорной (дифосфорной) и трифосфорной кислот (Рис. 2 .17)
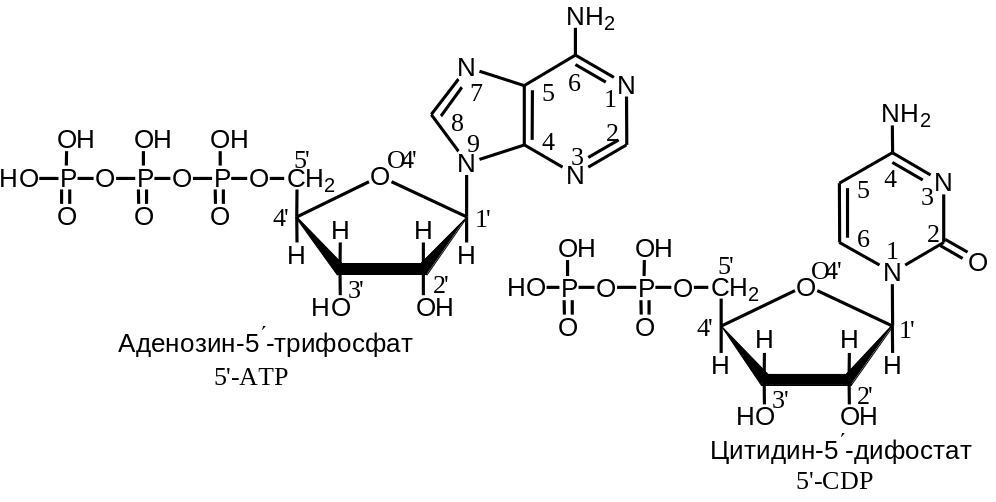
Рис. 2.17. Строение некоторых ди- и трифосфатов
1.3.2.Свойства нуклеозидов и нуклеотидов
Кислотно-основные свойства нуклеозидов и нуклеотидов
Нуклеозиды обладают либо слабыми основными (цитидин, аденозин), либо слабыми кислотными (уридин, тимидин и гуанозин) свойствами. Многочисленные физико-химические исследования позволили определить величины pKa и места преимущественного отщепления или присоединения протона (Рис. 2 .18).




Рис. 2.18. Кислотно-основные равновесия в растворе нуклеозидов (R — остаток рибофуранозы или 2‑дезоксирибофуранозы)
Нуклеотиды (как моно-, так и диэфиры фосфорной кислоты) являются кислыми водорастворимыми соединениями. Фосфатный остаток мононуклеотидов имеет два протона, способных к диссоциации (Рис. 2 .19)
![]()
Рис. 2.19. Ионизация фосфатной группы нуклеотидов (Nuc — остаток нуклеозида)
Таким образом, при pH 7 большая часть молекул моноэфира несет двойной отрицательный заряд
Наличие фосфата приводит к увеличению значений pKа нуклеиновых оснований (см.Рис. 2 .18) на несколько десятых. Этот сдвиг обусловлен стабилизацией положительно заряженных форм нуклеиновых оснований в нуклеотидах GMP, AMP и CMP или дестабилизацией отрицательно заряженных форм UMP, TMP и GMP за счет взаимодействия с отрицательным зарядом фосфатной группы.
Значения pKa 2-дезоксирибонуклеотидов на несколько десятых больше, чем у соответствующих рибонуклеотидов.
Таутомерия нуклеозидов
Нуклеиновые основания, нуклеозиды и нуклеотиды могут существовать в виде нескольких таутомеров (Рис. 2 .20). Наиболее устойчивые таутомеры помещены на Рис. 2 .20 в рамку. Однако по оценкам, разность энергий между таутомерными формами невелика, поэтому вопрос о том, играют ли необычные таутомеры какую-либо роль в формировании структуры или функционировании нуклеиновых кислот, остается открытым. В настоящее время прямые данные на этот счет отсутствуют.

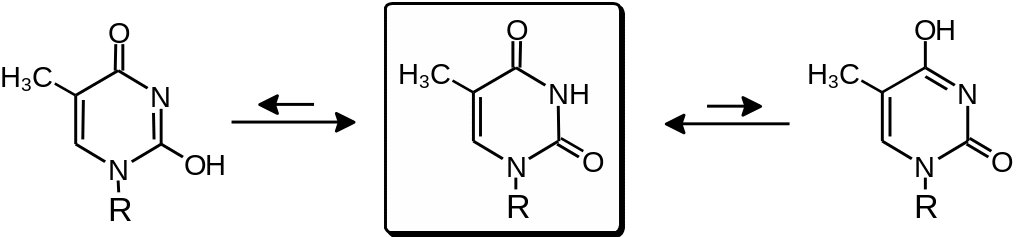

Рис. 2.20. Таутомеры гуанозина, тимидина (уридина) и цитидина. Наиболее стабильные таутомеры нуклеозидов обведены рамкой (R — остаток рибозы или дезоксирибозы)
Стабильность нуклеозидов в растворе
Как и все гликозиды, нуклеозиды устойчивы в щелочных средах, но относительно легко подвергаются кислому гидролизу. Рибонуклеозиды существенно более стабильны к кислотному гидролизу по сравнению с 2-дезоксирибонуклеозидами. В каждом классе соединений пуриновые основания отщепляются гораздо легче пиримидиновых. Полученные к настоящему времени экспериментальные данные согласуются с механизмом, включающим предравновесное протонирование гетероциклического основания с последующим скоростьлимитирующим гетеролизом гликозидной связи. Легкость отщепления пуриновых оснований в кислых средах широко используется при анализе ДНК и ее комплексов с белками.
