
- •Глава 1.Мономеры клетки
- •Неполярные аминокислоты
- •Полярные незаряженные аминокислоты
- •Заряженные аминокислоты
- •1.1.1.Кислотно-основное равновесие в растворе -аминокислот
- •1.1.2.Некоторые химические свойства -аминокислот
- •1.2.Моносахариды
- •1.3.Нуклеозиды и нуклеотиды
- •1.3.1.Строение и номенклатура
- •1.3.2.Свойства нуклеозидов и нуклеотидов
- •1.3.3.Конформация нуклеозидов и нуклеотидов
- •1.4.Липиды
- •1.4.1.Химическое строение липидов
- •1.4.2.Фосфолипиды
- •1.4.3.Стероиды
1.1.2.Некоторые химические свойства -аминокислот
Химические свойства -аминокислот в основном определяются поведением содержащихся в них функциональных групп — карбоксильной группы, аминогруппы и функциональной группы бокового радикала (коль скоро таковая присутствует). Здесь мы остановимся на химических особенностях, интересных с биохимической точки зрения.
Для обнаружения небольших количеств аминокислот наиболее широко используется нингидриновая реакция (Рис. 2 .5).
При нагревании аминокислот с избытком нингидрина образуется продукт лилового цвета, если аминокислота содержит свободную -аминогруппу, и желтый продукт, если, как у пролина, ее ‑аминогруппа защищена. Этот метод обладает высокой чувствительностью и используется как для качественного, так и для количественного (колориметрического) определения аминокислот.


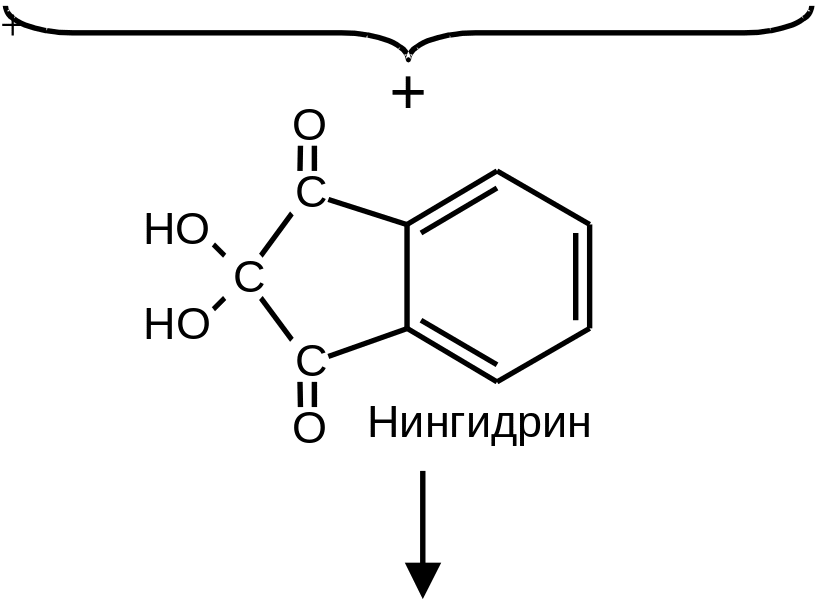

Рис. 2.5. Нингидриновая реакция, используемая для обнаружения и количественного определения ‑аминокислот. Атомы аминокислоты отмечены жирным шрифтом. Пигмент содержит две молекулы нингидрина и атом азота аминокислоты
Для определения аминокислотной последовательности пептидов важное значение имеет реакция аминокислот с 1‑фтор-2,4-динитробензолом (Рис. 2 .6).
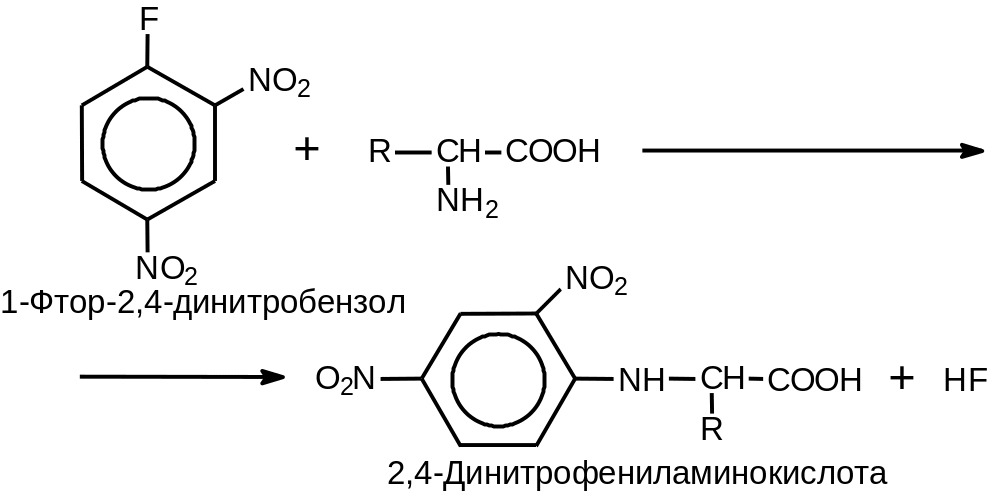
Рис. 2.6. Образование 2,4-динитрофенильных производных аминокислот
SH-Группа цистеина чрезвычайно легко в окислительных условиях образует S–S-связь (Рис. 2 .7).
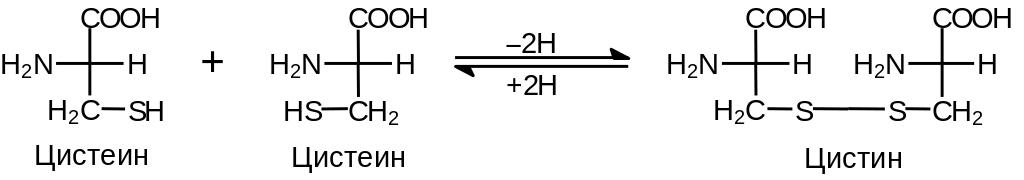
Рис. 2.7. Цистеин и цистин. Образование S–S-мостиков. В белках встречается как цистин, так и цистеин
Эта реакция проходит уже в присутствии газообразного кислорода. Обратная реакция легко протекает под действием даже слабых восстановителей. Образование S–S-связей играет важную роль в организации третичной структуры белка (см. ниже).
Отметим, что все -аминокислоты, входящие в состав белков, имеют атом водорода у ‑углеродного атома. Это очень важная особенность, на которой основан метаболизм ‑аминокислот в живых организмах.
1.2.Моносахариды
Углеводороды представляют собой полигидроксиальдегиды или полигидроксикетоны. Первые называют альдозами, а вторые — кетозами. По длине углеродной цепи (числу атомов углерода) углеводы подразделяют на тетрозы (четыре атома углерода), пентозы (пять атомов), гексозы (шесть атомов), гептозы (семь атомов) и т.д. В природе наиболее распространены пентозы и гексозы.
Первые выделенные из природных источников сахара (так же, как и большинство известных в настоящее время) имели химическую формулу Сn(H2О)n. Именно поэтому они получили название углеводы. В дальнейшем были получены сахара с другим соотношением углерода и кислорода, а также содержащие и другие гетероатомы (азот, серу).
Углеводы, молекула которых представляет одну структурную единицу (полигидроксиальдегид или полигидроксикетон), называют моносахаридами.
Простейшим представителем альдоз является глицериновый альдегид CH2(OH)CH(OH)CHO. Это соединение имеет один хиральный центр и, поэтому, может существовать в виде двух энантиомеров (Рис. 2 .8):

Рис. 2.8. Энантиомеры глицеринового альдегида
Два энантиомера глицеринового альдегида являются родоначальниками двух рядов углеводов: D- и L-ряда.
Рассмотрим конфигурацию альдоз (до альдогексоз включительно) D-ряда (в природе почти исключительно встречаются сахара именно D-ряда). Начиная с родоначальника D-ряда — D-глицеринового альдегида, мы будем наращивать углеродную цепь на один хиральный центр (Рис. 2 .9). При этом образуются два диастереомера, различающиеся конфигурацией нового хирального центра. Диастереомеры, различающиеся конфигурацией лишь одного хирального центра, называются эпимерами. Любая пара сахаров одного ряда соотносятся как диастереомеры. Сахара L-ряда являются энантиомерами соответствующих сахаров D-ряда.

АЛЬДОТЕТРОЗЫ

АЛЬДОПЕНТОЗЫ

АЛЬДОГЕКСОЗЫ


Рис. 2.9. Стереохимический ряд D-альдоз (хиральный центр, определяющий принадлежность к D‑ряду, выделен жирными линиями)
Сходным образом можно изобразить конфигурацию всех кетоз D-ряда (природные кетозы содержат карбонильную группу во втором положении углеродной цепи). Все они характеризуются D‑конфигурацией наиболее удаленного от кетогруппы хирального центра. Поскольку в кетозах на один хиральный центр меньше, чем в альдозах с тем же числом атомов углерода, то и число стереоизомеров вдвое меньше. Название кетоз образуют, вводя суффикс -ул- в название соответствующей альдозы: рибоза рибулоза (некоторые кетосахара имеют тривиальные названия). На Рис. 2 .10 представлено строение наиболее биологически важных кетоз.

Рис. 2.10. Строение некоторых биологически важных кетоз
Сахара на Рис. 2 .9 представлены в виде линейных структур. Такая форма соответствует лишь строению триоз и тетроз. Альдозы, содержащие пять и более атомов углерода, и кетозы, содержащие шесть и более атомов углерода, существуют как в растворе, так и в кристалле практически полностью в форме внутренних циклических полуацеталей.
Циклические структуры образуются при атаке гидроксигруппы при четвертом или пятом атоме углерода на собственную карбонильную группу сахара (Рис. 2 .11).

Рис. 2.11. Обратимое замыкание внутреннего полуацеталя на примере D-глюкозы (шестичленная пиранозная форма) и D-рибозы (пятичленная фуранозная форма)
Внутренние ацетали сахаров могут быть пяти- или шестичленными. Размер цикла обозначают, заменяя окончание -за в названии сахара на -фураноза в случае пятичленного цикла или -пираноза в случае шестичленного цикла. Образование полуацеталя сопровождается превращением плоской (а, значит, ахиральной) карбонильной группы в хиральный центр. Этот новый, возникающий при образовании циклического полуацеталя хиральный центр называют аномерным, а пару диастереомеров, различающихся конфигурацией лишь при аномерном центре — аномерами.
Для изображения циклических форм сахаров обычно используют проекции Хейуорса (Рис. 2 .11).
В каноническом написании проекций Хейуорса цикл располагают так, чтобы атом С1 находился справа, связи C1–C2, C2–C3 и C3–C4 выступали на нас (на Рис. 2 .11 это обозначено широкими линиями), а ацетальный кислород уходил за плоскость рисунка. Для описания конфигурации при аномерном центре используют греческие буквы “” и “”. В канонической проекции Хейуорса сахаров D-ряда ‑аномеру отвечает расположение аномерной гидроксигруппы над циклом, а -аномеру — под циклом. В случае сахаров L-ряда в -аномере гидроксигруппа располагается под циклом.
Следует иметь в виду, что в действительности шести- и пятичленные кольца неплоские. Шестичленное кольцо большинства сахаров имеет конфигурацию кресла (Рис. 2 .12). Неплоской является и фуранозная форма.
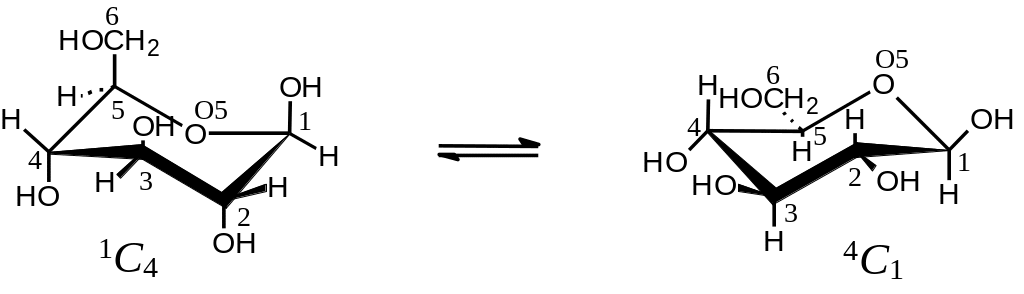
Рис. 2.12. Две конформации кресла -D-глюкопиранозы. Буква “С” означает конформации кресла (Chair); цифры указывают какой из атомов отогнут вверх (надстрочный индекс), а какой — вниз (подстрочный индекс) при каноническом написании проекции
Обычно в равновесной смеси преобладает тот конформер, в котором наибольшее число объемистых заместителей располагаются на экваториальных связях. ‑D‑Глюкопираноза существует в растворе практически полностью в виде 4С1-конформера (все объемистые заместители расположены на экваториальных связях).
