
- •Глава 1.Мономеры клетки
- •Неполярные аминокислоты
- •Полярные незаряженные аминокислоты
- •Заряженные аминокислоты
- •1.1.1.Кислотно-основное равновесие в растворе -аминокислот
- •1.1.2.Некоторые химические свойства -аминокислот
- •1.2.Моносахариды
- •1.3.Нуклеозиды и нуклеотиды
- •1.3.1.Строение и номенклатура
- •1.3.2.Свойства нуклеозидов и нуклеотидов
- •1.3.3.Конформация нуклеозидов и нуклеотидов
- •1.4.Липиды
- •1.4.1.Химическое строение липидов
- •1.4.2.Фосфолипиды
- •1.4.3.Стероиды
Глава 1.Мономеры клетки
1.1.-Аминокислоты
Большинство аминокислот, участвующих в биохимических превращениях, содержат первичную аминогруппу, находящуюся в -положении к карбоксильной функции. Во всех природных аминокислотах, входящих в состав белков (за исключением глицина), ‑углеродный атом представляет собой хиральный центр. Для описания конфигурации в случае -аминокислот обычно используют относительную D,L-номенклатуру. Считают, что кислота относится к L-ряду, если в каноническом написании фишеровской проекции аминогруппа расположена слева (Рис. 2 .1).

Рис. 2.1. Конфигурация -аминокислот
Все природные аминокислоты, входящие в состав белков, относятся именно к L-ряду.
Таким образом, -аминокислоты различаются лишь строением радикала R, который называют боковым радикалом или боковой группой. Поскольку с точки зрения абсолютной R,S-стереохимической номенклатуры боковой радикал всегда имеет меньшее старшинство, чем карбоксильная и аминогруппа, все L-аминокислоты имеют S-конфигурацию при -атоме. В зависимости от строения бокового радикала аминокислоты подразделяют на неполярные (содержат неполярный гидрофобный радикал), полярные не заряженные и полярные заряженные (содержат полярный гидрофильный боковой остаток). Часто в отдельную группу выделяют ароматические аминокислоты (фенилаланин, тирозин, триптофан и гистидин). Наиболее распространенные -аминокислоты приведены на Рис. 2 .2.
Неполярные аминокислоты

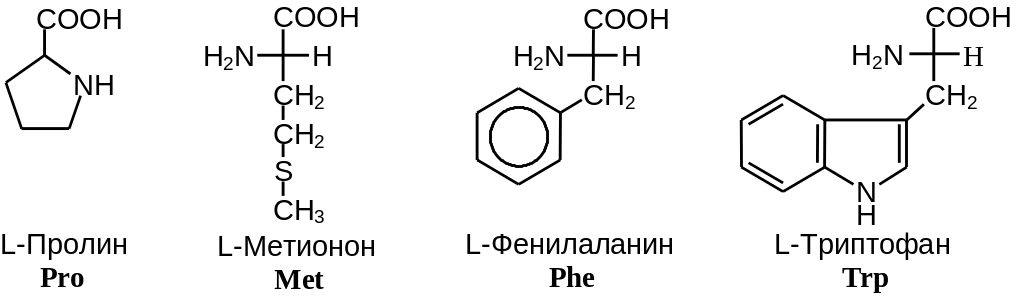
Полярные незаряженные аминокислоты

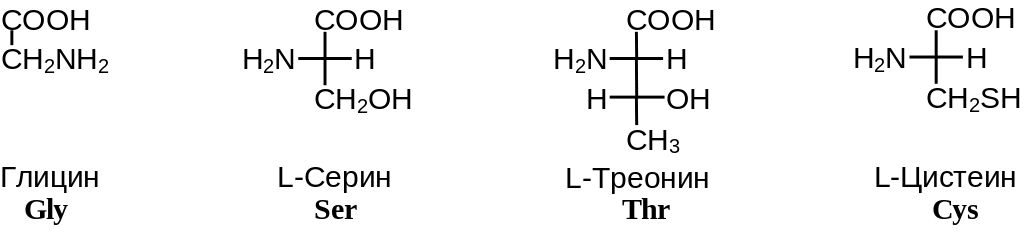
Заряженные аминокислоты
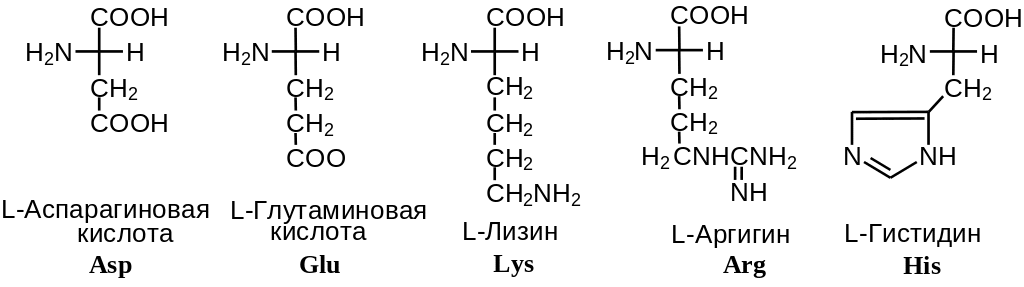
Рис.2.2. Наиболее распространенные -аминокислоты
Сразу следует указать, что в нейтральных растворах все аминокислоты ионизованы (то есть, заряжены, см. следующий раздел). Приведенный выше термин «заряженные аминокислоты» относится исключительно к боковому радикалу аминокислоты и отражает тот факт, что в боковом радикале содержится функциональная группа, которая либо теряет протон при рH, близком к 7, (отрицательно заряженные аминокислоты), либо, наоборот, присоединяет (положительно заряженные аминокислоты).
Из 20 -аминокислот, приведенных на Рис. 2 .2, 17 обладают одним хиральным центром (то есть, могут существовать в виде двух энантиомеров), одна ахиральна (глицин) и две имеют два хиральных центра (изолейцин и треонин). Каждая из этих двух аминокислот может существовать в виде четырех стереоизомеров. Рассмотрим стереохимию и номенклатуру этих соединений на примере треонина (Рис. 2 .3).

Рис. 2.3. Стереоизомеры треонина
Встречающийся в белках L-треонин является (2-S, 3‑R)-стереоизомером. Его энантиомер называют D‑треонином. Для обозначения их диастереомеров используют приставку «алло» (алло по-гречески означает другой).
1.1.1.Кислотно-основное равновесие в растворе -аминокислот
-Аминокислоты обладают как минимум двумя ионогеннными группами — карбоксилом и аминогруппой. Поскольку атом азота и двойная связь C=O разделены двумя ординарными связями, сопряжение карбоксильной группы со свободной электронной парой азота невозможно по пространственным соображениям. Взаимное влияние функциональных групп может осуществляться только по механизму индуктивного эффекта. Поскольку аминогруппа проявляет –I-эффект, который существенно увеличивается при протонировании, она должна повышать кислотность карбоксила.
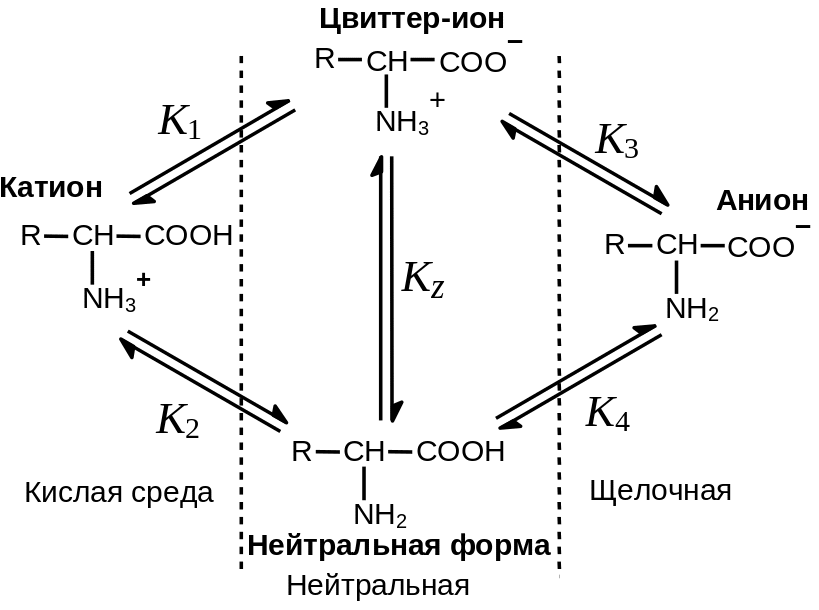
Рис. 2.4. Кислотно-основное равновесие в растворе ‑аминокислот
В свою очередь, неионизованная карбоксильная группа (–I-эффект) должна понижать основность аминогруппы, а ионизованный карбоксил за счет сильного +I-эффекта будет усиливать основные свойства NH2-группы.
В сильно кислой среде -аминокислоты существуют в виде двухосновной кислоты (катион на Рис. 2 .4). В сильно щелочной среде будет преобладать анион. В нейтральных средах могут присутствовать две незаряженные формы — нейтральная и биполярная (последнюю часто называют цвиттер-ионом). Соотношение нейтральной и биполярной форм определяется относительной силой двух кислотных группировок катиона (-COOH и ‑NH3+). Чем больше кислотность карбоксильной группы по сравнению с аммонийной (или чем основнее аминогруппа по сравнению с карбоксилат-анионом), тем сильнее равновесие сдвинуто в сторону цвиттер-иона.
-Аминокислоты в нейтральных средах существуют практически полностью в виде цвиттер-иона.
Характеристическое значение рH, при котором концентрация цвиттер-иона максимальна называют изоэлектрической точкой (pI).. Поскольку в целом молекула цвиттер-иона электронейтральна, электропроводность раствора в такой точке будет минимальной, а молекула аминокислоты не будет смещаться в электрическом поле.
При отсутствии ионизирующихся групп в боковом радикале изоэлектрическая точка лежит при pH, численно равном среднему арифметическому двух величин pKэфф.
В Табл. 2 .1приведены величины pKэфф и pI некоторых аминокислот.
Табл. 2.1. Экспериментально измеренные pK и изоэлектрические точки -аминокислот
Аминокислота |
pKэфф |
pI |
||
|
COOH |
-NH2 |
Боковая группа |
|
Aланин |
2,3 |
9,9 |
– |
6,0 |
Аргинин |
1,8 |
9,0 |
12,5 |
11,2 |
Аспарагин |
2,0 |
8,8 |
– |
5,4 |
Аспарагиновая кислота |
2,0 |
10,0 |
3,9 |
2,8 |
Валин |
2,3 |
9,6 |
– |
6,0 |
Гистидин |
1,8 |
9,2 |
6,0 |
7,5 |
Глицин |
2,4 |
9,8 |
– |
6,0 |
Глутамин |
2,2 |
9,1 |
– |
5,7 |
Глутаминовая кислота |
2,2 |
9,7 |
4,3 |
3,2 |
Изолейцин |
2,4 |
9,7 |
– |
6,0 |
Лейцин |
2,4 |
9,6 |
– |
6,0 |
Лизин |
2,2 |
9,2 |
10,8 |
9,6 |
Метионин |
2,3 |
9,2 |
– |
5,7 |
Пролин |
2,0 |
10,6 |
– |
6,3 |
Серин |
2,1 |
9,2 |
– |
5,7 |
Тирозин |
2,2 |
9,1 |
10,9 |
5,7 |
Треонин |
2,6 |
10,4 |
– |
5,6 |
Триптофан |
2,4 |
9,4 |
– |
5,9 |
Фенилаланин |
1,8 |
9,1 |
– |
5,5 |
Цистеин |
1,8 |
10,8 |
8,3 |
5,1 |
Практически важно, что в изоэлектрической точке аминокислоты обладают наименьшей растворимостью.
