
- •Инновационные аспекты промышленной органической химии
- •Что изучает промышленная органическая химия?
- •Основные инновационные направления промышленной органической химии
- •Каталитический крекинг углеводородов
- •Механизм процесса каталитического крекинга
- •Катализаторы процесса каталитического крекинга
- •Контрольные вопросы для проверки знаний по теме “Каталитический крекинг”
- •Рекомендуемая литература
- •Алкилирование непредельных углеводородов предельными углеводородами
- •Контрольные вопросы для проверки знаний по теме : «Алкилирование непредельных углеводородов предельными углеводородами»
- •Алкилирование ароматических соединений непредельными соединениями
- •Контрольные вопросы для проверки знаний по теме : «Алкилирование ароматических соединений непредельными соединениями»
- •Ароматизация предельных углеводородов
- •Спилловер водорода
- •Цитированная литература
Спилловер водорода
Как уже отмечалось выше, эффективным катализатором ароматизации предельных углеводородов является платина, нанесенная на окись алюминия. Высокой активностью обладают также катализаторы, где в качестве основы используют такие полярные соединения, как двуокись циркония, двуокись титана, окись магния и.т.д. Высокой активностью обладает платина, нанесенная на активированный уголь. Однако неудовлетворительные механические свойства этого катализатора сдерживают его применение в промышленности. В последние годы в качестве носителя металла начали использовать различные марки цеолитов. Условием работоспособности всех указанных нанесенных катализаторов является одно необычное требование – в реакционной системе должен находиться водород. В отсутствии водорода катализаторы быстро закоксовываются и, поэтому, теряют свою активность.
Приведенное выше термодинамическое рассмотрение ароматизации алканов свидетельствует о том, что этот процесс является обратимым. Для реакции:
Алкан Аром. соединение + 4 Н2 ,
равновесная концентрация ароматического соединения выражается уравнением:
Из приведенного уравнения следует, что чем выше концентрация молекулярного водорода в реакционной смеси, тем ниже должна быть равновесная концентрация образующегося ароматического соединения. При всей справедливости этого утверждения, тем не менее, как это показывают экспериментальные данные, без дополнительного введения водорода в реакционную систему процесс ароматизации алканов осуществить невозможно. Это необычное явление вызвало пристальный интерес. Его всестороннее исследование показало, что водород является важным участником процесса ароматизации. Оказалось, что в присутствии платины молекулярный водород диссоциирует с образованием атомарного водорода:
Н2 2Н .
Атомарный водород далее подвергается ионизации с образованием протона и электрона:
Н Н+ + е.
Электроны частично захватываются кластерами платины, и они локализуются также в массе носителя. Протоны же закрепляются на поверхности носителя. Оказалось, что локализованные на поверхности носителя протоны играют важнейшую роль в развитии процесса ароматизации.
В системе Pt/Al2O3 молекулы водорода первоначально адсорбируются атомами платины. Платина обеспечивает диссоциацию молекулярного водорода на атомарный. За каталитическую активность этой системы ответственны протоны, находящиеся на поверхности носителя. Явление переноса сорбированных на одной фазе (металл) частиц на другую фазу (носитель платины, например, Al2O3) с образованием каталитически активных соединений, которые на этой фазе не образуются в отсутствии металла, получило название спилловера (англ. spill over – перетекать).
Явлению спилловера водорода посвящено ряд обзорных работ [3-7]. Рассмотрим экспериментальные данные, подтверждающие существование явления спилловера водорода.
Количество поглощенного водорода. Окись алюминия, активированный уголь практически не адсорбируют молекулярный водород. Крайне незначительные количества водорода способна растворять платина [8]. Более значительные количества водорода способен поглощать палладий (3 атома водорода на 4 атома палладия). Однако ситуация резко меняется, если на эти носители нанести кластеры палладия, платины. В таблице 18 приведены данные работы [9], в которой изучалось поглощение водорода механической смесью активированного угля и угля с нанесенной в количестве 1% платиной.
Таблица 18. Адсорбция водорода на механической смеси активированного угля (С) и платины на активированном угле (Pt/C) при 298К [9]
Соотношение С : Pt/C, масс. |
Соотношение Н/Pt, атомы |
0 (только Pt/C) |
3.2 |
3 : 1 |
21 |
9 : 1 |
66 |
20 : 1 |
160 |
50 : 1 |
360 |
99 : 1 |
700 |
Из приведенных в таблице 18 данных видно, что активированный уголь с нанесенной в количестве 1% платины поглощает водород в количестве до 3.2 атомов водорода на 1 атом платины. С увеличением количества активированного угля в механической смеси (происходит уменьшение концентрации платины !) поглощение водорода резко возрастает. Невозможно представить ситуацию, когда 700 атомов водорода будут удерживаться одним атомом платины. Наиболее вероятным является то, что эти атомы водорода закреплены на поверхности активированного угля.
Явление спилловера водорода является полностью обратимым. При вакуумировании системы поглощенный первоначально водород может быть полностью удален (рис. 1).
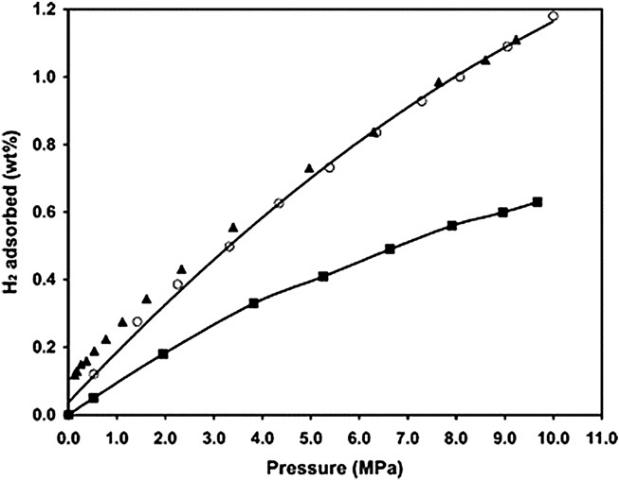
Рис. 1. Изотермы адсорбции – десорбции водорода на платинированном активированном угле при 298К: o – адсорбция, ▲ – десорбция [10].
Способность платинированного активированного угля поглощать большое количество водорода предлагается использовать в настоящее время для создания устройств для хранения водорода.
Соотношение H/Pt на катализаторе Pt/Al2O3 достигает 10 [5]. Палладий на носителе Al2O3 – La2O3 поглощает до 15 атомов водорода на 1 атом палладия [11].
Явление повышенного поглощения водорода не раскрывает вопрос о том, в какой форме и как закрепляется водород на поверхности носителя. Ответ на это вопрос был получен в последующих экспериментах.
Восстановление окислов. Желтые окислы вольфрама, молибдена (WO3, MoO3) восстанавливаются при высоких температурах (600-7000С) молекулярным водородом с образованием окрашенных в сине-фиолетовый цвет соединений низшей валентности [12], например:
2WO3 + H2 → 2 WO2OH ,
2 WO2OH + H2 → 2 WO(OH)2 .
Необходимость высоких температур в этой реакции обусловлена тем, что восстановление осуществляется не молекулярным водородом, а атомарным. Распад же молекулярного водорода на атомарный в сколь-нибудь заметной степени возможен только при высоких температурах. Молекула водорода является одной из наиболее устойчивых из известных. Если в какой-либо системе, по каким-то причинам образуется атомарный водород, то указанные превращения можно использовать для доказательства его возникновения.
Способность окислов вольфрама, молибдена образовывать окрашенные соединения с атомарным водородом при обычных температурах, было использовано для исследования процессов, происходящих при спилловере водорода.
В таблице 19 приведены данные работы [13], в которой изучалось поведение WO3, Al2O3, Pt/ Al2O3 и их смесей в атмосфере водорода.
Таблица 19. Изменение окраски WO3 в присутствии Al2O3 и Pt/ Al2O3 при комнатной температуре в атмосфере водорода [13]
Смесь |
WO3, % объем. |
Al2O3, % объем. |
Pt/ Al2O3, % объем. |
Начальная окраска |
Время выдержки |
Конечная окраска |
A |
100 |
0 |
0 |
Желтая |
300 мин. |
Желтая |
B |
50 |
50 |
0 |
Желтая |
300 мин. |
Желтая |
C |
50 |
0 |
50 |
Желтая |
1 мин. |
Синяя |
Как видно из данных таблицы 19, WO3, и его смесь с Al2O3, в атмосфере азота продолжительное время остаются неизменными (смеси А и В). Однако композиция WO3 и Pt/ Al2O3 (смесь С) быстро приобретает синюю окраску. Эти данные указывают на то, что в присутствии системы Pt/ Al2O3 молекулярный водород диссоциирует на атомарный:
Н2 2Н .
В работе [13] отмечается, что синяя окраска смеси С (таблица 19) при 500С появляется в атмосфере водорода практически моментально.
В работе [14] показано, что такие металлы, как родий, рутений, палладий, платина, нанесенные на двуокись титана вызывают восстановление Ti(IV) до Ti(III):
TiO2 + H → O=Ti-OH.
Без нанесенных металлов восстановление двуокиси титана не происходит [14].
Улавливание спилловерных атомов водорода спиновыми ловушками. Существует ряд соединений, такие как нитроны, нитрозосоединения, которые способны реагировать с короткоживущими радикалами и образовывать долгоживущие радикальные частицы. Эти радикалы далее можно зарегистрировать методом электронного парамагнитного резонанса (ЭПР). Подобного типа соединения получили название спиновых ловушек. В качестве спиновой ловушки часто используют С-фенил-N-трет-бутилнитрон, который реагирует с радикалами с образованием устойчивых нитроксильных радикалов:
 Метод спиновых
ловушек был использован для доказательства
образования атомарного водорода из
молекулярного водорода в системах,
содержащих метал на полярной поверхности.
Метод спиновых
ловушек был использован для доказательства
образования атомарного водорода из
молекулярного водорода в системах,
содержащих метал на полярной поверхности.
В работе [15] С-фенил-N-трет-бутилнитрон был применен для фиксации атомарного водорода, образующегося в системе Pd/Al2O3 в атмосфере водорода. Условия эксперимента были следующими. На поверхность окиси алюминия, содержащей 0,04% Pd, наносили раствор С-фенил-N-трет-бутилнитрона в хлористом метилене. Затем растворитель удаляли в вакууме. Полученный образец помещали в атмосферу водорода (давление 105 Па) и выдерживали 10 минут при 250С. Полученные при этом продукты затем экстрагировали хлористым метиленом, и их исследовали методом ЭПР. В результате был получен четкий спектр N-бензил-N-трет-бутилнитроксильного радикала (рис. 2):


Рис. 2. ЭПР-спектр N-бензил-N-трет-бутилнитроксильного радикала [15].
Явление восстановления окислов металлов, непосредственный перехват атомов водорода спиновыми ловушками, свидетельствует о том, что спилловер водорода действительно сопровождается диссоциацией молекулярного водорода на атомарный. Этот факт, казалось бы, противоречит существующим представлениям в химии.
Как уже отмечалось, молекула водорода является одной из самых устойчивых. Энергия диссоциации молекулярного водорода на атомарный составляет 104 ккал/моль [16]. Поэтому рекомбинация двух атомов водорода с образованием молекулы водорода является энергетически очень выгодным процессом. В силу этой причины экспериментально атомы водорода не должны были бы определяться. Противоречие может быть разрешено, если в рассматриваемых системах протекают еще какие-то процессы, энергетика которых позволяет нивелировать высокий эндотермический эффект стадии диссоциации водорода. Последующее исследование спилловера водорода показало, что это явление не ограничивается только диссоциацией молекулярного водорода на атомарный. На более сложную картину указывает изотопный обмен в гидроксильных группах носителей.
Изотопный обмен в гидроксильных группах носителей и алкильных группах адсорбированных веществ. Частоты валентных колебаний связей О-Н и О-D, которые проявляются в инфракрасных спектрах, отличаются друг от друга. Полосы поглощения связей О-D (мономерных форм и ассоциатов), по сравнению с полосами поглощения связей О-Н, сдвигаются в сторону низких частот [17]. Отношение νОН/νOD составляет в среднем величину 1,35 [17]. Это обстоятельство позволяет легко различать связи О-Н и O-D при использовании метода инфракрасной спектроскопии.
Поверхность окиси алюминия содержит гидроксильные группы, которые имеют максимумы поглощения при 3785, 3740 и 3710 см-1. При обработке образцов окиси алюминия дейтерием (D2) интенсивности поглощения в указанных выше областях практически не меняется. Однако если на поверхность окиси алюминия нанести платину, то в атмосфере дейтерия указанные полосы постепенно исчезают, и появляются новые полосы поглощения при 2790, 2755, 2730 см-1 [18]. Новые полосы поглощения относятся к связям O-D. На рис. 3 приведены инфракрасные спектры образцов окиси алюминия, на которую было нанесено 0,6% платины. Как видно из приведенных данных, с увеличением времени обработки дейтерием, происходит постепенное уменьшение интенсивности полос поглощения связей О-Н, вплоть до их полного исчезновения. Параллельно этому появляются полосы поглощения, которые относятся к связям O-D, интенсивность которых возрастает с увеличением времени контакта с газообразным дейтерием.
Приведенные данные указывают на то, что в ходе взаимодействия дейтерия с системой Pt/Al2O3 происходило генерирование дейтронов (положительно заряженных атомов дейтерия). Именно их наличие позволяет
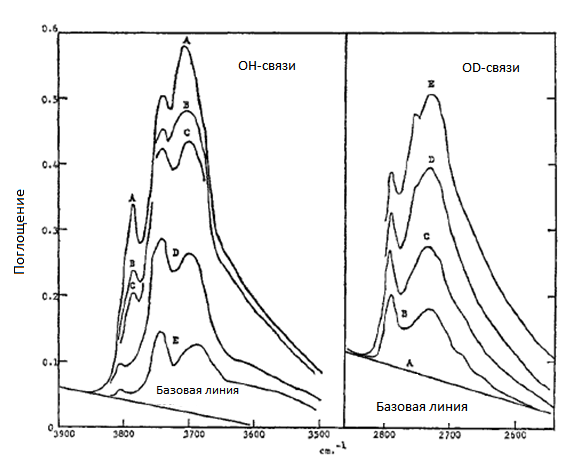
Рис. 3. Изменение интенсивности полос поглощения в инфракрасной области поверхности 0,6% Pt/Al2O3 в зависимости от времени выдержки в атмосфере дейтерия (D2). Время обработки дейтерием: A – 0; B – 1; C -10; D – 100; E – 1130 мин. [18].
понять явление изотопного обмена, который был описан выше. Дейтроны образуют при взаимодействии с атомами кислорода гидроксильных групп ониевые катионы, которые, отщепляя протоны, превращаются в группы O-D (рис.4). Приведенная схема предполагает, что атомарный водород, образующийся первоначально в ходе спилловера водорода, далее подвергается ионизации:
H → H+ + e .

Рис. 4. Схема изотопного обмена протонов гидроксильных групп на поверхности окиси алюминия на дейтроны.
Процесс изотопного обмена протонов на дейтерий, который обсуждался выше, является обратимым. При действии дейтерия можно превратить связи О-Н в связи О-D. Однако если на эту систему вновь подействовать обычным водородом (Н2), то связи О-D превращаются в связи O-H [19].
Изотопный обмен может происходить не только в поверхностных гидроксильных группах носителя катализатора. Если на поверхности носителя адсорбированы какие-либо вещества, то в процесс изотопного обмена вовлекаются и связи этого соединения. Например, в работе [20] показано, что в циклопентане, адсорбированным на системе Pd/Al2O3 в присутствии дейтерия происходит обмен связей C-H на связи C-D [20]. Процесс включает промежуточное образование карбониевых ионов:
1
В адсорбированных на катализаторе 5% Pd/CaCO3 аминокислотах в атмосфере трития (Т2) происходит обмен связей С-Н на связи С-Т [21,22]. Это легкий способ получения меченных тритием аминокислот.
Ионизация атомарного водорода в условиях спилловера на протоны и электроны приводит к образованию носителей электрического тока. Существуют явления ионной и электронной электропроводности. Если приведенные выше суждения верны, то в присутствии водорода у катализаторов благородный металл/полярный носитель должна появиться электропроводность. Экспериментальное обнаружение данного явления служило бы дополнительным доказательством образования протонов и электронов при спилловере водорода.
Спилловер водорода и электропроводность. Окись алюминия является хорошим диэлектриком и характеризуется крайне низкой электропроводностью. Чистая окись алюминия в присутствии водорода продолжает оставаться диэлектриком [3]. На рис. 5 приведены данные работы [23], в которой изучена электропроводность образцов γ-Al2O3 в атмосфере сухого водорода, влажного водорода и аргона.
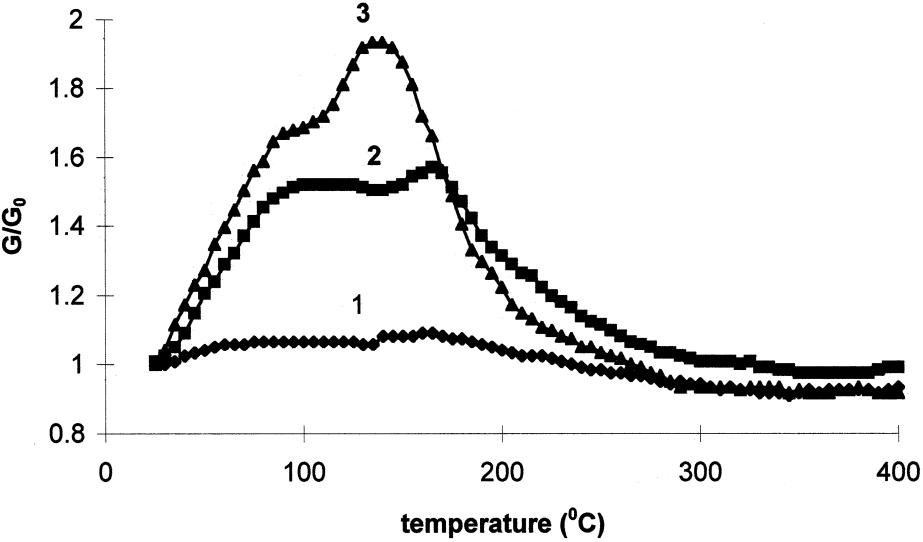
Рис. 5. Относительная электропроводность (λ/λо) образцов γ-Al2O3 в зависимости от температуры в атмосфере сухого водорода (1), влажного аргона (2), влажного водорода (3) [23].
Из рис. 5 видно, что в атмосфере сухого водорода в широком интервале температур электропроводность образцов γ-Al2O3 практически не меняется. Незначительно электропроводность возрастает во влажном аргоне. Аргон является инертным газом, и протекание каких-либо превращений с его участием исключено. Возрастание электропроводности в атмосфере влажного аргона обусловлено тем, что вода является слабым электролитом, которая диссоциирует с образованием ионов:
Н2О Н+ + НО− .
Образовавшиеся ионы из адсорбированной на поверхности γ-Al2O3 и обуславливают возрастание электропроводности системы. Диссоциация воды на ионы возрастает с увеличением температуры [24]. Это приводит к возрастанию электропроводности с увеличением температуры (кривая 2, рис. 5). При высоких температурах количество адсорбированный воды уменьшается, что сопровождается уменьшением электропроводности. Влажный водород ведет себя сходно со влажным аргоном.
На рис. 6 приведены закономерности изменения электропроводности системы 0,5% Pt/ γ-Al2O3 в этих же средах.
Наблюдаемые тенденции, приведенные на рис. 6, отличны от данных рис. 5. Электропроводность катализатора 0,5% Pt/ γ-Al2O3 в атмосфере сухого водорода (кривая 1, рис. 6) возрастает в десятки раз. Этот результат указывает на то, что в присутствии платины молекулярный водород распадается с образованием носителей тока (электронов и протонов) гораздо легче, чем в отсутствии платины.
Сильно возрастает электропроводность (в 70 раз) системы 0,5% Pt/ γ-Al2O3 в атмосфере влажного аргона (кривая 2, рис. 6). Эти данные свидетельствуют о том, что платина способствует не только распаду молекулярного водорода на протоны и электроны, но она вызывает распад и молекул воды с образованием ионов. Понижение электропроводности системы 0,5% Pt/ γ-Al2O3 в атмосфере влажного аргона с увеличением температуры связано, как и в предыдущем случае, с уменьшением количества сорбированной воды при высоких температурах.
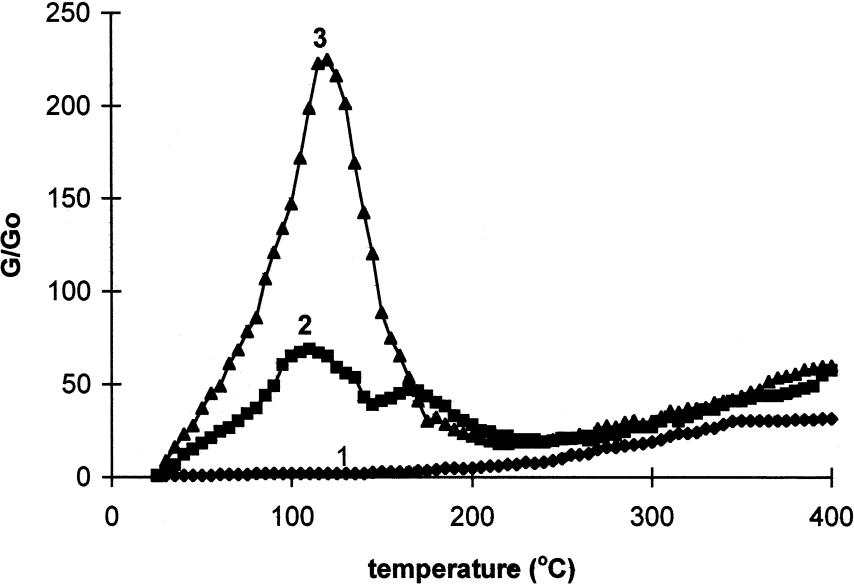
Рис. 6. Относительная электропроводность образцов (λ/λо) 0,5% Pt/ γ-Al2O3 в зависимости от температуры в атмосфере сухого водорода (1), влажного аргона (2) и влажного водорода (3) [23].
В сотни раз возрастает электропроводность катализатора 0,5% Pt/ γ-Al2O3 в атмосфере влажного водорода (кривая 3, рис. 6). Присутствие воды способствует распаду молекулярного водорода на электроны и протоны. Для понимания наблюдаемых зависимостей необходимо рассмотреть термохимические закономерности процессов, связанных со спилловером водорода.
Как уже отмечалось выше, диссоциация молекулярного водорода на атомарный является эндотермическим процессом, и сопровождается поглощением 104 ккал/моль тепла [16]:
H2 → 2H – 104 ккал.
Ионизация атомарного водорода с образованием протона и электрона требует затрат 314 ккал/г-атом энергии [25]:
Н → Н+ + е – 314 ккал.
Суммарно процесс трансформации молекулярного водорода в протоны и электроны требует затрат 732 ккал энергии на 1 моль Н2:
H2 → 2Н+ + 2е – 732 ккал.
Образующиеся в ходе ионизации электроны могут захватываться либо окисью алюминия, либо кластерами платины. Сродство к электрону окиси алюминия составляет 86 ккал/моль, а платины – 49 ккал/моль [26]. Таким образом, электроны должны, в первую очередь, находиться на свободных (вакантных) молекулярных орбиталях окиси алюминия. Протоны, возникающие в ходе ионизации атомарного водорода, присоединяются по неподеленным парам электронов атомов кислорода с окиси алюминия:
Наиболее легко протонируются поверхностные гидроксильные группы окиси алюминия. Сродство к протону мостиковых атомов кислорода уступает им. Усредненная величина сродства к протону окиси алюминия равна 204,5 ккал/моль [27].
Таким образом, при захвате двух электронов и двух протонов окисью алюминия выделяется 581ккал тепла. Однако, с учетом предыдущих затрат энергии, суммарная энтальпия процесса составляет 151 ккал. Таким образом, расщепление молекулы водорода на два атома водорода, ионизация этих атомов с образованием электронов и протонов, захват электронов и протонов окисью алюминия в целом является сильно эндотермичным процессом. Равновесие эндотермичных процессов сдвигается в сторону продуктов при повышении температуры. В нашем случае при повышении температуры увеличивается количество носителей тока. Поэтому при повышении температуры в системе Pt/ γ-Al2O3 в атмосфере водорода происходит многократное возрастание электропроводности (кривая 1, рис. 6).
Неаддитивное, сильное возрастание электропроводности происходит в системе Pt/ γ-Al2O3 в присутствии влажного водорода (кривая 3, рис.6). Вода образует ассоциаты с атомами кислорода и водорода, которые находятся в структуре окиси алюминия:


Образованные за счет водородной связи ассоциаты имеют важную особенность: их основность всегда выше, чем отдельных мономерных молекул. В качестве примера в таблице 20 приведены данные по сродству к протону и газофазной основности различных ассоциатов воды.
Таблица 20. Сродство к протону (РА) и газофазная основность (GB) ассоциатов воды при 298К [28]
Ассоциат |
РА, ккал/моль |
GB, ккал/моль |
Н2О |
165.1 |
157.7 |
(Н2О)2 |
198.6 |
182.5 |
(Н2О)3 |
219.4 |
195.5 |
(Н2О)4 |
236.8 |
204.6 |
(Н2О)5 |
249.1 |
210.3 |
Из приведенных в таблице 20 данных следует, что основность ассоциатов воды сильно возрастает при увеличении в них количества мономерных звеньев.
Процесс взаимодействия протонов со смешанными ассоциатами на поверхности окиси алюминия сопровождается большим выделением энергии по сравнению с присоединением протона к неассоциированным группам. Поэтому равновесие ионизации молекулярного водорода в присутствии воды сдвигается в правую сторону. При этом увеличивается количество носителей тока, что ведет к возрастанию электропроводности (кривая 3, рис. 6).
Иные закономерности в изменениях электропроводности наблюдаются при использовании в качестве носителя углерода. В работе [28] изучена электропроводность чистого аморфного углерода в вакууме и атмосфере водорода, а также системы Pd/C в вакууме и в атмосфере водорода (рис. 7). Специальными экспериментами было показано, что палладий занимал не более 5% поверхности аморфного углерода.
Аморфный углерод обладает некоторой электропроводностью, однако, как это следует из рис. 7, его электропроводность одинакова как в вакууме, так и в атмосфере водорода. Отсюда следует, что на поверхности аморфного углерода в атмосфере водорода не возникают дополнительные носителя тока, т.е. сам по себе углерод не вызывает распад молекулярного водорода. Всплески в электропроводности аморфного углерода (рис.7, верхняя кривая) при создании давления водорода и вакуума обусловлены механическим перемещением частиц аморфного углерода при этих воздействиях. Эти механические перемещения меняли характер контактов между частицами углерода.
Электропроводность системы Pd/C в вакууме несколько выше, чем аморфного углерода (рис.7, нижняя кривая). Это обусловлено тем, что кластеры платины на поверхности аморфного углерода создают участки с хорошей электрической проводимостью. В силу этого общее электрическое сопротивление уменьшается. В атмосфере же водорода происходит не возрастание электропроводности, как этого можно было бы ожидать, а
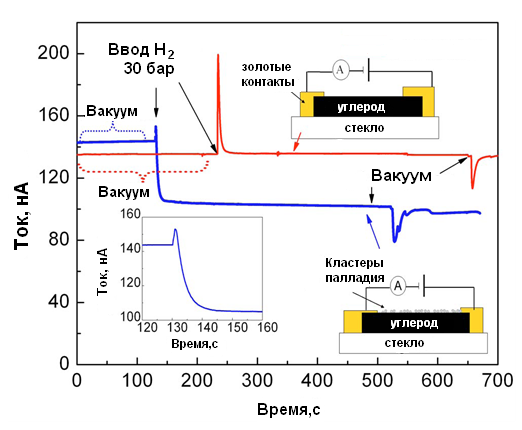
Рис. 7. Электропроводность аморфного углерода в вакууме и в атмосфере водорода (верхняя кривая) и системы Pd/C в вакууме и атмосфере водорода (нижняя кривая) при 250С [28]
наоборот, понижение электропроводности. Из рис. 7 видно, что данное явление носит необратимый характер. При вакуумировании электропроводность не восстанавливается.
С химической точки зрения аморфный углерод представляет собой смесь высокоароматизированных углеводородов. Эти фрагменты являются ответственными за электропроводность. Понижение электропроводности системы Pd/C в атмосфере водорода авторы работы [28] объясняют тем, что в условиях спилловера водорода происходит частичное гидрирование ароматических фрагментов угля. Поэтому электропроводящие ароматические структуры в угле начинают пространственно разделяться насыщенными фрагментами, которые не проводят электрического тока. Как следствие, наблюдается понижение необратимое понижение электропроводности.
