
- •Атомная и ядерная физика
- •1.Физика атомного ядра
- •2.Физика частиц
- •Лекция (вводная) физика атома
- •1.Постулат стационарных состояний: электрон в атоме находится в состояниях в которых он не излучает. Спектр энергий атома дискретный. Где главное квантовое число.
- •2.Условие частот: электрон в атоме, переходя из одного стационарного состояния в другое состояние , излучает (или поглощает) квант электромагнитной энергии
- •3.Правило квантования орбит: момент импульса электрона в стационарном состоянии при движении по орбите квантован
- •Модуль2 физика атомного ядра лекция 1 физика ядра
- •1.1.2. Дефект массы ядра. Энергия связи ядра слайд2
- •Нукл/см3, (1.12)
- •1.3.4.Гамма-излучение возбужденных ядер и его характеристики. Эффект Мёссбауэра (ядерный гамма-резонанс).
- •Лекция 2 ядерные реакции
- •1.4.Ядерные реакции
- •1.Реакция синтеза изотопов водорода дейтрона и тритона с образованием ядра гелия и нейтрона:
- •2. Реакция синтеза двух дейтронов:
- •1.Превращение водорода в гелий, происходящее на звездах, в реакциях водородного и углеродного циклов.
- •1.5.1.Прохождение тяжелых заряженных частиц (протонов, α-частиц) через вещество. Формула Бора для ионизационных потерь
- •1.5.3. Прохождение гамма-квантов через вещество. Закон ослабления узкого пучка гамма-квантов. Линейный и массовый коэффициент ослабления. Взаимодействие γ-квантов с веществом
- •1.5.4. Прохождение нейтронов через вещество. Ослабление потока нейтронов. Замедление нейтронов. Диффузия нейтронов
- •1.6.1.Источники заряженных частиц. Ускорители. Источники γ-квантов. Источники нейтронов
- •Лекция 4 ядерные реакторы
- •[Част/см2] (3.4)
- •[Част/см2 сек] (3.5)
- •3.2.2. Действие ионизирующих излучений на структуру вещества. Химическое действие ядерных излучений
- •1.Степень(легкая): нервнорегуляторные нарушения сердечно-сосудистой системы и нестойкое умеренное падение количества эритроцитов и реже падение количества тромбоцитов.
- •2.Способность рождаться и уничтожаться при с помощью сильного, электромагнитного, или слабого взаимодействий между ними.
- •3.Элементарные частицы разделяются на классы лептонов (легкие), адронов (сильные) и калибровочных бозонов.
- •2.2.2.Экспериментальное подтверждение кварковой модели адронов. Эксперименты в области высоких энергий
- •2. Искривление пространства-времени определяется не только массой вещества, но и всеми видами энергии физических полей присутствующими в системе.
- •3.Изменения гравитационного поля распространяются в вакууме со скоростью света. Сравнение свойств гравитационного и других взаимодействий см. В табл.2.6
- •0 Ступень –базовый ускоритель - инжектор подает протоны с энергией 50 Мэв подает в бустер (промежуточный накопитель) и затем в первую ступень.
- •2.Принцип Коперника – Наше положение во Вселенной не является центральным, выделенным.
- •2.Плотность вещества во Вселенной близка к критической плотности 4,7 10-30 г/см3.
- •3.Общее вещество во Вселенной состоит из видимого (светящегося) вещества, темной материи и темной энергии.
- •4.Во Вселенной не обнаружено заметного количества антивещества (барионная ассиметрия Вселенной).
- •6.Вселенная обладает крупномасштабной трехмерной ячеисто-сетчатой структурой в виде «пены».
- •Модуль2 Физика атомного ядра
- •Модуль 3 Физика частиц
- •Литература.
Лекция (вводная) физика атома
Опыт Резерфорда.
Полуклассическая модель атома водорода
Корпускулярно-волновой дуализм
Соотношение неопределенности Гейзенберга
Волновая функция
Уравнения Шредингера. Примеры
Операторы физических величин
Атом водорода
Молекула
Молекулярные спектры
Кристалл. Уровни энергии электрона в периодическом поле
Зонная теория
Атомная физика- раздел физики, в котором изучают строение и свойства атомов и процессы с их участием.
Атом – наименьшая частица химического элемента, способная самостоятельно существовать и проявлять его свойства. Атом состоит из ядра и электронов. Электрический заряд ядра положительный равный отрицательному заряду электронов, следовательно, атом электрически нейтрален.
Строение атома было открыто Э.Резерфордом в 1911г. в опытах по рассеянию альфа-частиц на золотой пластинке. Очень малая часть альфа-частиц (дважды ионизированные атомы гелия) летящие с громадной скоростью рассеивались под большими углами, и даже назад, налетая на положительно заряженный массивный силовой центр внутри атома. Так возникла планетарная модель атома: в центре ядро вокруг него движутся электроны.
Формула Резерфорда для дифференциального сечения рассеяния

где![]() - элемент телесного угла «кулёк»).
- элемент телесного угла «кулёк»).
Дифференциальное
сечение рассеяния
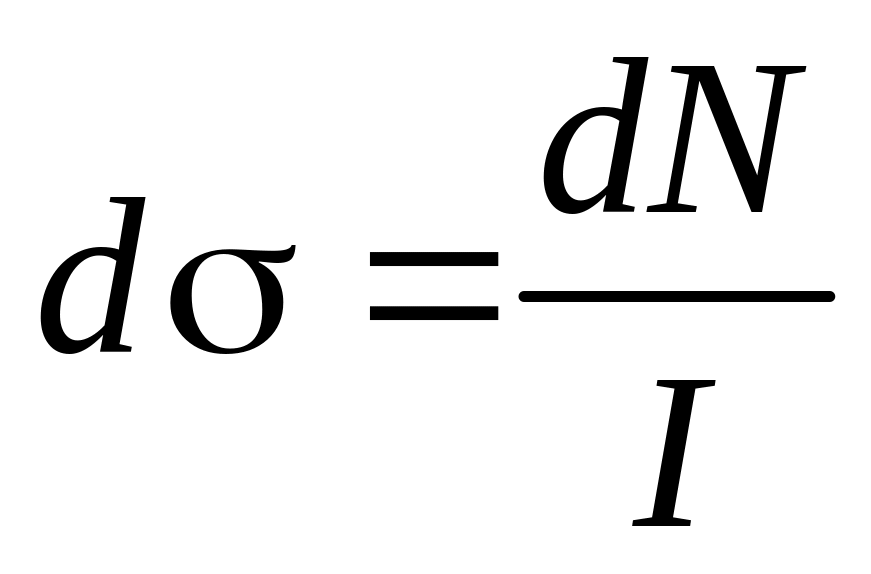 =
=![]() число
частиц падающих на кольцо /плотность
потока частиц. См рис 1.Рассеяние
число
частиц падающих на кольцо /плотность
потока частиц. См рис 1.Рассеяние
![]() -угол
рассеяния.
-угол
рассеяния.

рис 1.Рассеяние
Полуклассическая модель атома водорода предложенная Н.Бором основа на трех постулатах:
1.Постулат стационарных состояний: электрон в атоме находится в состояниях в которых он не излучает. Спектр энергий атома дискретный. Где главное квантовое число.
2.Условие частот: электрон в атоме, переходя из одного стационарного состояния в другое состояние , излучает (или поглощает) квант электромагнитной энергии
![]()
3.Правило квантования орбит: момент импульса электрона в стационарном состоянии при движении по орбите квантован
![]()
Кулоновская сила, действующая между электроном и ядром атома водорода (протоном) равна центростремительной силе

Радиус первой боровской орбиты электрона в атоме водорода

Уровни энергии электрона в атоме водорода

Сериальная формула Бальмера-Ридберга для спектров излучения атома водорода
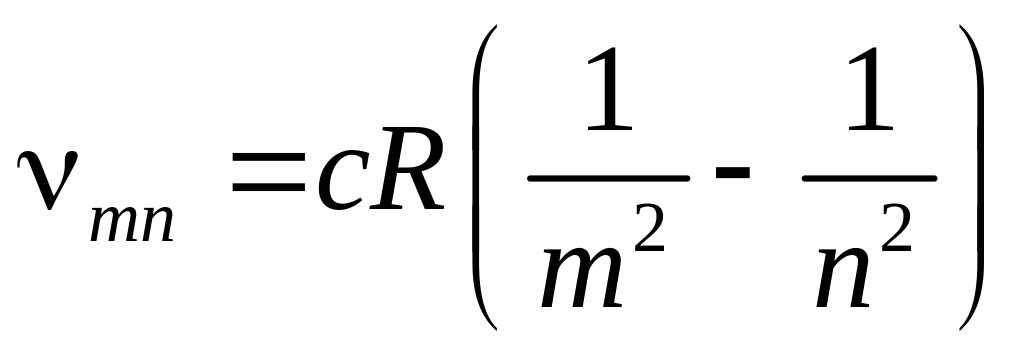 ;
где
;
где
![]()
 -серия Бальмера
(видимый свет).
-серия Бальмера
(видимый свет).
-нумерует серию, -нумерует линию в данной серии
См рис .2
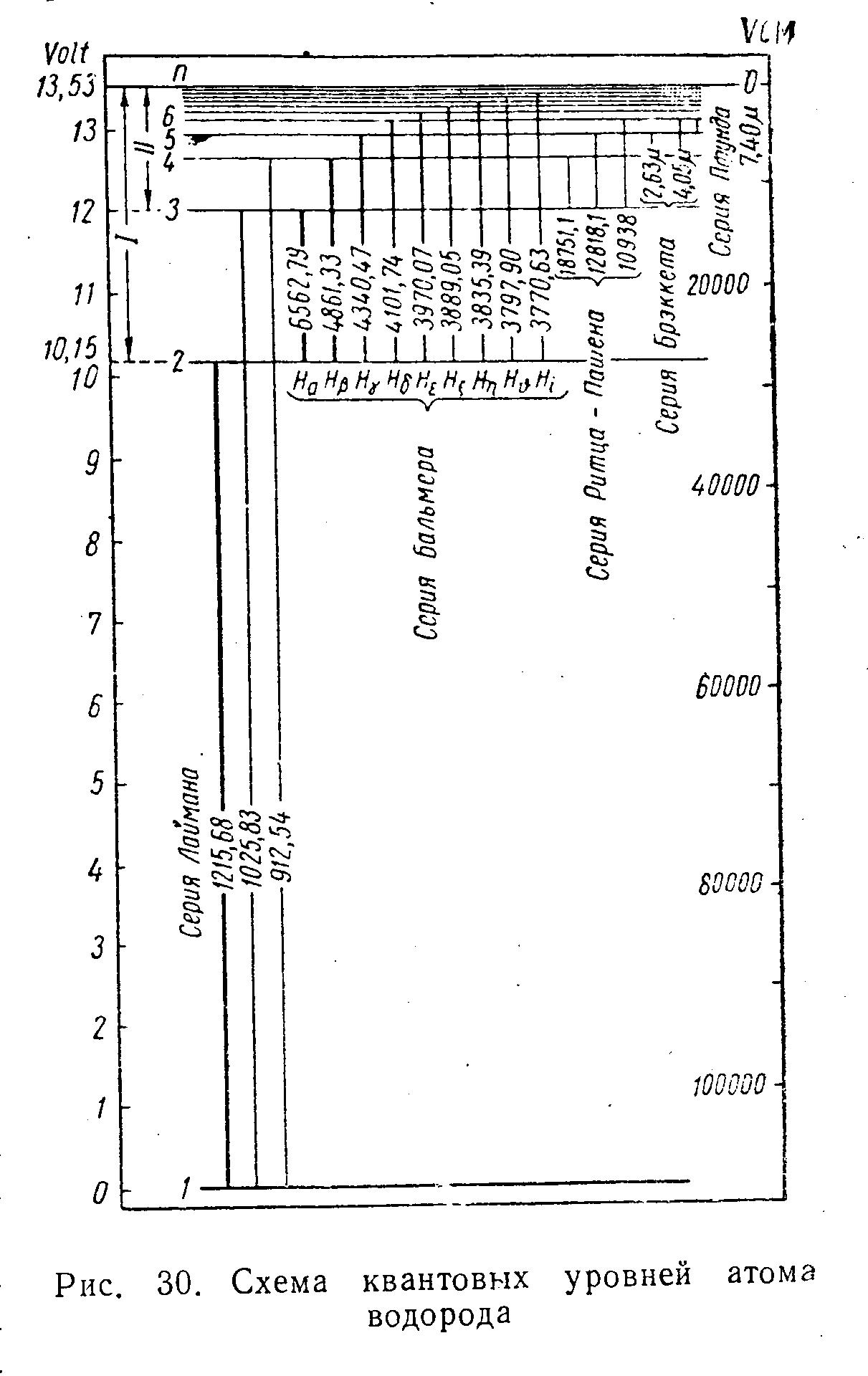
Рис2
Квантовая (волновая механика) - теория описывающая движение микрочастиц (молекул, атомов, ядер) и их систем.
Корпускулярно-волновой дуализм- всеобщее и универсальное свойство материи: любой волне соответствует частица и любой частице соответствует волна.
Энергия частицы
![]() ,где
,где
![]() -
частота волны, импульс частицы
-
частота волны, импульс частицы
![]() где
где
 -волновой вектор, длина волны вероятности
де Бройля
-волновой вектор, длина волны вероятности
де Бройля
 .
.
В квантовой механике нет понятия «траектория частицы» вследствие соотношения неопределенности Гейзенберга:
![]() ,
,
![]() ,
,
![]() .
.
Т.е. невозможно
одновременно локализовать микрочастицу
и фиксировать её импульс
 см рис3
см рис3

рис 3 Соотношение неопределенностей
Чем точнее определяется значение энергии частицы, тем большее время для этого требуется
![]()
Комплексная
волновая функция
![]() описывает состояние квантовой системы
в пространстве и времени.
описывает состояние квантовой системы
в пространстве и времени.
Вероятность![]() обнаружить частицу в объеме
обнаружить частицу в объеме
![]() определяется по формуле
определяется по формуле

Условие нормировки
![]() .
.
Уравнения Шредингера
Временно’е
уравнение Шредингера описывает эволюцию
квантовой системы

Где
Стационарное
уравнение Шредингера описывает поведение
частицы находящейся в заданном силовом
поле
![]()

 - оператор
Лапласа
- оператор
Лапласа
Пример1.Движение
свободной частицы вдоль оси х
с импульсом
![]()
Уравнение
Шредингера
 .
.
Его решение
 ,
энергия частицы
,
энергия частицы
 .
Спектр энергии непрерывен, (волновая
функция осциллирует), вероятность
нахождения частицы в любой точке оси
единица.
.
Спектр энергии непрерывен, (волновая
функция осциллирует), вероятность
нахождения частицы в любой точке оси
единица.
Пример2. Движение
свободной частицы с энергией
![]() через одномерный потенциальный
прямоугольный барьер конечной ширины
через одномерный потенциальный
прямоугольный барьер конечной ширины
![]() и высоты
и высоты
![]() .
.
Уравнения
Шредингера
![]() ,
,![]()
![]() область 1 до барьера
область 1 до барьера
![]() ,
,![]()
![]() область 2 барьер
область 2 барьер
![]() ,
,![]()
![]() область3 после барьера
область3 после барьера
При падении на
барьер волновая функция![]() осциллирует, частично отражается,
частично проходит внутрь барьера. Внутри
барьера волновая функция ослабляется
по экспоненте
осциллирует, частично отражается,
частично проходит внутрь барьера. Внутри
барьера волновая функция ослабляется
по экспоненте![]() .
При выходе из барьера снова осциллирует
.
При выходе из барьера снова осциллирует
![]() .
Таким образом, существует неравная нулю
вероятность прохождения потенциального
барьера. Она характеризуется коэффициентом
прозрачности прямоугольного барьера
.
Таким образом, существует неравная нулю
вероятность прохождения потенциального
барьера. Она характеризуется коэффициентом
прозрачности прямоугольного барьера
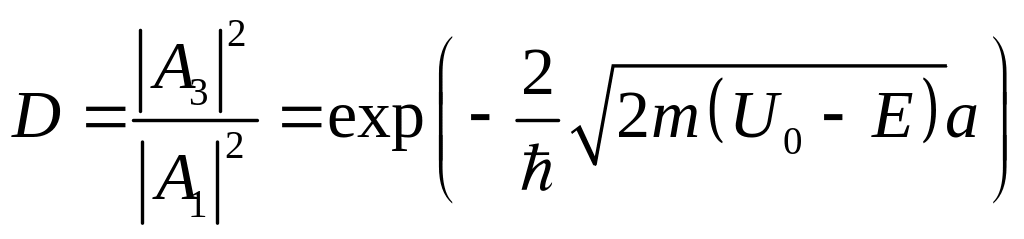

Рис 4 Прохождение квантовой частицы через барьер
Операторы физических величин
Каждой физической
величине
![]() соответствует линейный эрмитовый
оператор
соответствует линейный эрмитовый
оператор![]() .
Этот оператор принимает собственные
значения
.
Этот оператор принимает собственные
значения
![]() на
базисе собственных функций
на
базисе собственных функций![]() .
.
Собственные значения оператора соответствуют возможным значениям физической величины.
Собственные функции оператора соответствуют собственным состояниям, отвечающим выбранному собственному значению.
Оператор энергии
(гамильтониан)
![]() - энергия
- энергия
Векторный оператор
импульса
 - импульс
- импульс
Квадрат оператора
момента импульса
![]()
![]() -квадрат
момента импульса
-квадрат
момента импульса
Оператор
![]() -компоненты
момента импульса
-компоненты
момента импульса

![]()
![]() -
-компонента
момента импульса
-
-компонента
момента импульса
Оператор вектора
спина
![]()
![]()
Оператор
-компоненты
вектора спина
![]()
![]()
Состояние электрона в атоме полностью определяется четыремя квантовыми числами
![]()

Пример Электрон в кулоновском поле ядра (атом водорода)
Определить энергию электрона и волновые функции стационарных состояний.
Решение:
Пишем стационарное
уравнение Шредингера
 .
Задача обладает сферической симметрией.
Поэтому используем сферические координаты
.
Задача обладает сферической симметрией.
Поэтому используем сферические координаты
![]() ,
Потенциальная энергия электростатического
поля
,
Потенциальная энергия электростатического
поля
 .
Оператор Лапласа разделяем на радиальную
и угловую части
.
Оператор Лапласа разделяем на радиальную
и угловую части .
Заменяем
.
Заменяем
![]() и
получаем для радиальной части волновой
функции
и
получаем для радиальной части волновой
функции
![]() .
.
Уравнение

имеет решение

Вероятность
нахождения электрона в основном состоянии
в интервале![]() :
:
 .
.
В ядре электрона нет, наибольшая вероятность нахождения электрона на расстоянии первого боровского радиуса, далее она падает по экспоненте. См рис 5

Рис.5
В общем случае уровни энергии соответствуют формуле Бора:
Волновая функция зависит от трех квантовых чисел
![]()
где
![]() -сферические
гармоники.
-сферические
гармоники.
Принцип Паули: В каждом квантовом состоянии может находится только один электрон.
Пример.
![]() . На уровне энергии
. На уровне энергии
![]() могут находится электрон в состоянии
могут находится электрон в состоянии
 ,
и электрон в состоянии
,
и электрон в состоянии
 .Это
атом гелия с двумя электронами. Атом
лития имеет три электрона, поэтому два
электрона находятся в состояниях
.Это
атом гелия с двумя электронами. Атом
лития имеет три электрона, поэтому два
электрона находятся в состояниях![]() :
:
 ,
один электрон находится в одном из двух
состояний
,
один электрон находится в одном из двух
состояний![]() :
:
 ,
остальные шесть состояний
,
остальные шесть состояний
![]() :
:
 ,
, пустые.
пустые.
Заполнение
квантовых состояний электронами
происходит в соответствие с принципом
минимума энергии и принципом Паули. При
этом электроны заполняют низшие
энергетические состояния группируясь
в электронные
оболочки(![]() )
от ядра наружу. Число электронов в
оболочках
)
от ядра наружу. Число электронов в
оболочках
![]()
равно .
Оболочки состоят из подоболочек:
.
Оболочки состоят из подоболочек:
![]() ;
;
![]() …
…
Так объясняется периодическая система химических элементов Д.И.Менделеева.
Молекулы
Молекула –наименьшая частица вещества обладающая его свойствами и состоящая из атомов соединенных химическими связями.
Образование
молекулы водорода. В первом приближении
можно считать ядра атомов неподвижными
и рассматривать только движение двух
электронов. Если спины электронов
антипараллельны то спин молекулы
 если параллельны то
если параллельны то![]() Энергия взаимодействия двух электронов
Энергия взаимодействия двух электронов

![]() -электростатическая
энергия взаимодействия
-электростатическая
энергия взаимодействия
![]() -обменная
энергия (обмен электронами между
состояниями)
-обменная
энергия (обмен электронами между
состояниями)
Два атома водорода с антипараллельными спинами притягиваются образуют гомополярную молекулу водорода.
Два атома водорода с параллельными спинами отталкиваются. График потенциальной энергии взаимодействия атомов водорода в зависимости от расстояния между электронами приведен на рис .6

Рис6 Энергия взаимодействия двух атомов водорода для триплетного и синглетного состояний. В синглетном состоянии образуется устойчивая молекула водорода (нижняя кривая)
Молекулярные спектры
Полная энергия молекулы может быть представлена в виде суммы квантованных значений энергии соответствующим трем видам её внутренних движений: электронов, колебаний атомов в молекуле. Вращению молекулы как целого.
![]()
![]()
Молекулярные
спектры возникают при квантовых переходах
между уровнями энергии молекулы
![]() где
где
![]() -квант
испускаемого фотона частоты
-квант
испускаемого фотона частоты
![]() .
.
Колебательные уровни энергии
 где
где
![]() колебательное квантовое число
колебательное квантовое число
Вращательные уровни энергии
![]() где
где
![]() вращательное
квантовое число,
вращательное
квантовое число, -вращательная
постоянная,
-вращательная
постоянная,![]() -момент
инерции молекулы.
-момент
инерции молекулы.
Схема уровней энергии двухатомной молекулы показана на рис.7

Рис7 Уровни энергии молекулы.
![]()
Электронные молекулярные спектры лежат в видимой и ультрафиолетовой части спектра(УФ),
Колебательные спектры – в инфракрасном диапазоне(ИК)
Вращательные спектры – в микроволновом диапазоне (СВЧ).
Кристаллы
Электрон в периодическом поле кристаллической решетки. Уравнение Шредингера, волновая функция, спектр энергий.
Взаимодействие атомов приводит не только к образованию молекул .но и к макроскопическим твердым телам и жидкостям. Кристалл характеризуется дальним порядком - регулярным расположением атомов в кристаллической решетке. Кристалл обладает колебательными уровнями энергии и также электронными уровнями. Электроны во внутренних замкнутых оболочках атомов прочно связаны со своими ядрами. Электроны во внешних незамкнутых оболочках атомов могут быть свободно перемещаются по кристаллу. Тогда говорят, что они коллективизированы по кристаллу. Эти электроны называются электронами проводимости. Считаем, что они не взаимодействуют друг с другом. Поэтому можно рассматривать движение одного электрона в периодическом электрическом кристаллическом поле решетки.
Уравнение Шредингера принимает вид

Условие периодичности для потенциала
![]() где
где
![]() -произвольный
период решетки.
-произвольный
период решетки.
Тогда волновая функция имеет следующую структуру
![]()
Энергия электрона![]()
Где
-
дискретное число. Волновой вектор
электрона
![]() определен с точность до периода обратной
решетки
определен с точность до периода обратной
решетки![]() .
Так как
.
Так как
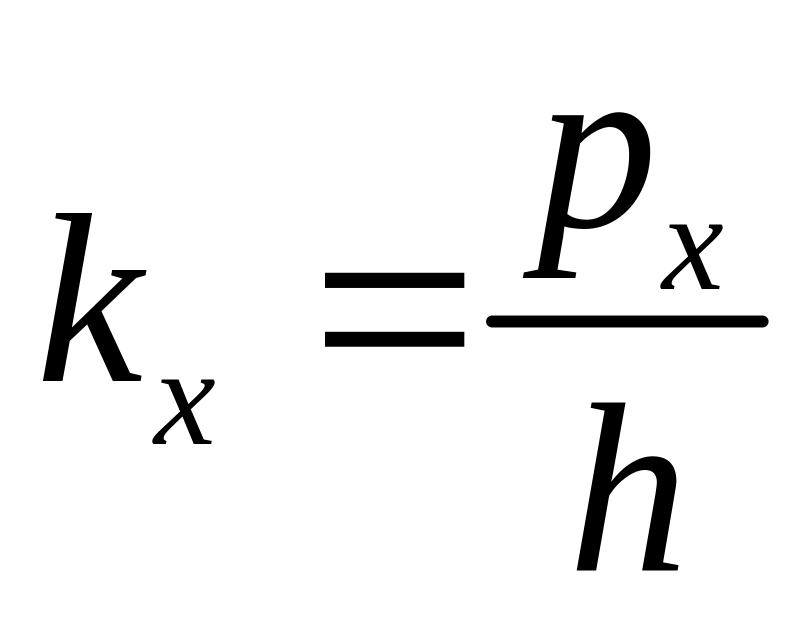 где
-импульс
по оси Х. получаем
где
-импульс
по оси Х. получаем
![]() где
где
![]() .
.
Электронное
состояние распадается на группы (зоны),
которые нумеруются числами
![]() :
:
![]() ,
,![]() ,
,![]()
Каждая зона содержит N уровней (равных числу атомов) , которые характеризуются различными значениями .
Эти зоны допустимых значений энергии отделены запрещенными областями энергии, которые недопустимы для электрона.
Зонная теория объясняет электрическую проводимость металлов, диэлектриков и полупроводников.
Зонная диаграмма –это графическая диаграмма распределения уровней энергии кристалла. Она состоит из зоны проводимости заполненной электронами остова, запрещенной зоны («энергетическая щель»в спектре энергий)где нет разрешенных уровней энергии, зоны проводимости состоящей из уровней энергии для коллективизированных электронов. См. рис.8 Зонные диаграммы металлов. полупроводников , и диэлектриков. Рис.9 Распределение электронного заряда в твердых телах.

Рис8 Зонные диаграммы металлов. полупроводников , и диэлектриков.

Рис9 Распределение электронного заряда в твердых телах.
