
15. Скорость химической реакции. Основной постулат химической кинетики
Скоростью химической реакции v называется количество молекул данного сорта, реагирующих в единицу времени в единице объёма; v = моль/(м3с). Основной постулат химической кинетики: скорость химической реакции прямо пропорциональна концентрациям реагирующих веществ в некоторых степенях:
v
= k
 ,
,
ni порядок реакции по данному веществу;
k
константа скорости химической реакции,
k
зависит от природы реакции и является
функцией температуры; v
= k
, если
 , то есть константа скорости химической
реакции есть скорость реакции при
условии, что концентрации реагирующих
веществ равны 1; k
иногда называют удельной
скоростью химической реакции.
Размерность константы скорости зависит
от порядка реакции.
, то есть константа скорости химической
реакции есть скорость реакции при
условии, что концентрации реагирующих
веществ равны 1; k
иногда называют удельной
скоростью химической реакции.
Размерность константы скорости зависит
от порядка реакции.
Средняя скорость реакции
 ,
,
 и
и

число молей одного из веществ в начальный
t
и конечный
t
моменты времени; V
объем системы. Знак «»
в выражении стоит тогда, когда мы следим
за ходом реакции по изменению количества
одного из исходных веществ, знак «+»
используют, если скорость реакции
определяют по ее продукту.
число молей одного из веществ в начальный
t
и конечный
t
моменты времени; V
объем системы. Знак «»
в выражении стоит тогда, когда мы следим
за ходом реакции по изменению количества
одного из исходных веществ, знак «+»
используют, если скорость реакции
определяют по ее продукту.
Если tt 0 , то получим истинную скорость реакции (скорость реакции в данный момент времени), рассчитанную на единицу стехиометрического коэффициента
v
=
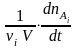 .
.
Если
V
= const,
то
v
=
 .
.
Задачи
15.1. Напишите выражения для скорости реакции разложения метана
СН4 газ С тв + 2Н2 газ
через парциальные давления метана и водорода.
15.2. Как изменится скорость реакции синтеза аммиака
1/2 N2 + 3/2 H2 NH3
если уравнение реакции записать в виде N2 + 3H2 2NH3 ?
15.3. Чему равен общий порядок элементарных реакций
а) Cl + H2 HCl + H ; б) 2NO + Cl2 2NOCl ?
15.4. Какие из перечисленных величин могут принимать а) отрицательные; б) дробные значения: скорость реакции, порядок реакции, молекулярность реакции, константа скорости реакции, стехиометрический коэффициент?
15.5. Как выражается скорость элементарной реакции
C2H5Br + OH– C2H5OH + Br–
через концентрации этанола и щелочи?
15.6. Может ли скорость сложной реакции зависеть от концентрации продуктов реакции?
15.7. Во сколько раз увеличится скорость прямой и обратной элементарных реакций А 2В в газовой фазе при увеличении давления в 3 раза?
15.8. В некоторый момент времени скорость сгорания циклогексана в избытке кислорода равна 0,350 моль/(лс). Чему равны скорость образования СО2 и скорость расходования кислорода в этот момент?
15.9. Скорость реакции образования NO в реакции
2NOBr газ 2NO газ + Br2 газ
равна 1,610–4 моль/(лс). Чему равна скорость реакции и скорость расходования NOBr? (v = 8,010–5 моль/(лс); dNOBr /dt = – dNO /dt = – 1,610–4 моль/(лс))
15.10. Определите размерность константы скорости для реакций первого, второго и третьего порядка, если концентрация выражена в моль/л.
15.11. Определите общий порядок сложной реакции, если константа скорости имеет размерность л1/2моль–1/2с–1 .
15.12. Реакция термического распада метана СН4 С + 2Н2 описывается кинетическим уравнением
 .
.
Определите порядок реакции по метану и по водороду, а также общий порядок реакции.
15.13. Константы скорости прямой и обратной элементарных реакций равны 2,2 и 3,8 л/(мольс). По какому из перечисленных ниже механизмов могут протекать эти реакции:
а) A + В D; б) A + В 2D; в) A В + D; г) 2A В ?
15.14. Реакция образования фосгена COCl2 из CO и Cl2 описывается кинетическим уравнением
 .
.
Определите общий порядок реакции при: а) высоких; б) низких концентрациях хлора.
15.15. Реакция разложения бромметана 2CH3Br C2H6 + Br2 описывается кинетическим уравнением
 .
.
Определите общий порядок реакции при: а) высоких; б) низких концентрациях бромметана.
15.16. Рассчитайте константу скорости в см3 /(мольс), л/(мольс), л/(мольмин), если скорость реакции 2-го порядка равна 4,510–7 моль/(см3с) при концентрации одного реагента 0,015 моль/л и другого 0,0025 моль/л.
(k = 12000 см3 /(мольс); 12 л/(мольс); 720 л/(мольмин))
15.17. Разложение Н2О2 в спиртовом растворе – реакция 1-го порядка. Начальная скорость реакции при концентрации перекиси 0,156 М равна 1,1410–5 моль/(лс). Рассчитайте константу скорости. (k = 7,3110–5 с–1 )
15.18. Скорость реакции 2-го порядка А + В С равна 2,710–7 моль/(лс) при концентрациях веществ А и В 0,003 моль/л и 2,0 моль/л, соответственно. Рассчитайте константу скорости. (k = 4,510–5 л/(мольс))
15.19. В реакции 2-го порядка А + В 2С начальные концентрации веществ А и В равны по 1,5 моль/л. Скорость реакции равна 2,010–4 моль/(лс) при А = 1,0 моль/л. Рассчитайте константу скорости и скорость реакции при В = 0,2 моль/л. (k = 210–4 л/(мольс); v = 810–6 моль/(лс))
15.20. При изучении инверсии (гидролиза) сахарозы были получены следующие данные:
-
Время, мин
0
30
90
130
180
C12H22О11 , М
0,500
0,451
0,363
0,315
0,267
Рассчитайте: 1) начальную скорость реакции; 2) истинную (мгновенную) скорость через 90 мин; 3) среднюю скорость за 180 мин. Реакция первого порядка.
(vо
= 1,7210–3;
v90
= 1,2510–3;
 =
1,2910–3
моль/(лмин))
=
1,2910–3
моль/(лмин))
15.21. При изучении скорости реакции (C2H5)3N + CH3J Р получены следующие данные (х – количество триэтиламина или иодистого метила, прореагировавшее за время t):
Время t , с |
1200 |
1800 |
2400 |
3600 |
4500 |
х , моль |
0,00876 |
0,01065 |
0,01208 |
0,01392 |
0,01476 |
Рассчитайте: 1) константу скорости реакции (реакция 2-го порядка); 2) начальную скорость реакции; 3) истинную скорость через 2400 с; 4) среднюю скорость за 1 час. Начальные концентрации амина и иодистого метила равны 0,0198 моль/л. (k = л/(мольмин); vо = ; v2400 = ; = моль/(лмин))
