
17. Кинетика сложных реакций
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарной реакцией обычно понимают единичный акт образования или разрыва химической связи. Для элементарных реакций общий порядок равен молекулярности, а порядки по веществам равны коэффициентам в уравнении реакции.
Изучение сложных реакций основано на принципе независимости (принципе сосуществования) реакций. Согласно этому принципу, если в системе одновременно протекает несколько реакций, то каждая из них независима от остальных и скорость ее прямо пропорциональна концентрациям реагирующих веществ. Конечное изменение концентрации данного вещества является результатом всех независимых изменений.
Применение принципа независимости сильно упрощает задачу составления уравнений для скоростей реакций. Однако принцип независимости различных реакций не выполняется, если химические реакции в системе протекают с настолько большими скоростями, что происходит нарушение закона распределения скоростей молекул Максвелла или если в результате образования продуктов реакции сильно изменяются свойства среды.
Другой принцип, применяемый при изучении кинетики сложных реакций – принцип детального равновесия: если сложная система находится в равновесии, то в каждой из элементарных стадий также соблюдается равновесие.
Таблица 3
Сложные реакции: обратимые, параллельные, последовательные
Реакция |
Дифференциальное уравнение скорости реакции |
Выражение для константы скорости реакции и количества вещества |
Обратимые реакции 1-го порядка |
= k1 (a – x) – k2 (b + x) ; = (k1 + k2) (L – x) , где
L =
|
k1
+ k2
=
k
=
ln
|
Обратимые реакции 2-го порядка |
= k1 (a – x)2 – k2 x2 ; = (k1 – k2) (x2
– 2
= (k1 – k2) (m1 – x) (m2 – x) |
k1
– k2 =
где
m1, 2 =
корни квадратного уравнения x2
– 2
|
Параллельные реакции 1-го порядка |
=
(k1 + k2) (a – x) |
k1
+ k2 =
ln
|
Параллельные реакции 2-го порядка |
= (k1 + k2)(a – x)(b – x) |
k1
+ k2 =
|
Последовательные реакции 1-го порядка |
Скорость превращения А: = k1 (a – x) ; скорость превращения В:
k1 (a – x) – k2 (x – y) = k1
а |
a – x = а ; x
– y = а
y
= a (1 –
|
Обозначения: а и b – исходные количества веществ А и В, моль; х – количество вещества А, прореагировавшее к моменту времени t , моль; y – количество вещества В, прореагировавшее к моменту времени t , моль; К = k1 / k2 – константа равновесия обратимой реакции; х – количество вещества А, прореагировавшее к моменту наступления равновесия (к концу реакции), моль. |
||
Задачи
17.1. Превращение роданида аммония NH4СNS в тиомочевину (NH2)2CS – обратимая мономолекулярная реакция. Рассчитайте константу скорости прямой и обратной реакций, используя следующие данные:
t , мин |
0 |
19 |
38 |
48 |
60 |
Доля прореагировавшего NH4СNS, % |
2,0 |
6,9 |
10,4 |
12,3 |
13,6 |
По
достижении состояния равновесия
концентрация роданида аммония составила
23,2%. (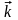 =
3,1410–3
мин–1;
=
3,1410–3
мин–1;
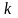 =
1,0410–2
мин–1)
=
1,0410–2
мин–1)
17.2. Образование этилового эфира муравьиной кислоты при 303 К протекает по уравнению реакции 1-го порядка:
НСООН + С2Н5ОН НСООС2Н5 + Н2О
Были получены следующие результаты:
t , мин |
0 |
1 700 |
10 000 |
14 000 |
20 000 |
40 000 |
Количество НСООН, мл |
29,44 |
28,59 |
24,77 |
23,05 |
21,28 |
16,80 |
Концентрация продукта прямой реакции в начальный момент времени равна 0. Константа скорости обратной реакции = 1,1510–5 мин–1 . Определите константу скорости прямой реакции. ( = )
17.3. Для реакции между иодистым метилом и раствором диметилпаратолуидина в нитробензоле
CH3C6H4N(CH3)2 + CH3J C10H16NJ
получены следующие данные:
-
t , мин
10,2
26,5
36,0
78,0
х/со
0,175
0,343
0,402
0,523
Константа равновесия реакции равна 69,8. Начальные концентрации обоих реагентов равны 0,05 моль/л, продукт в процессе реакции отводится. Определите, по какому кинетическому уравнению следует описать кинетическую кривую, и рассчитайте константу скорости реакции. (k = )
17.4. Реакции
С2H4 + HCl + HClO ––– |
(k1) |
ClC2H4OH + HCl |
(k2) |
C2H4Cl2 + H2O |
протекают параллельно. Вычислите константу скорости каждой реакции, если этилен взят в избытке, k2 /k1 = 0,0314, а концентрации, измеренные в начале опыта и в конце опыта (через 240 мин), составляют:
-
Начало опыта
Конец опыта
HCl , ммоль/л
8,675
3,695
HCl , ммоль/л
0,612
0,532
(k1 = ; k2 = )
17.5. Реакция термического крекинга нефти относится к консекутивным реакциям, причем бензин является промежуточным продуктом, распадающимся на газообразные вещества. Определите максимальную концентрацию бензина и время ее достижения при крекинге 1 т нефти, если при 673 К константа образования бензина k1 = 0,283 час–1 , а константа распада бензина k2 = 0,102 час–1 .
( = ; t = )
17.6. Покажите, что для реакций
А
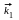 В , А
В , А
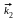 С
С
время, за которое образуется половина вещества В (по сравнению с его количеством при t = ), и время, за которое образуется половина количества С, одинаково, хотя константы k1 и k2 имеют разные значения.
17.7. Алкилирование изопропилбензола н-бутиленом в присутствии HF осуществляется по уравнению
А + В С , С + В D ,
где А – изопропилбензол; В – н-бутилен; С – изопропил-втор-бутилен; D – конечный продукт. Соотношение скоростей образования промежуточных и конечных продуктов в определенный момент времени равно 1,665. Массовый состав смеси к данному моменту (%): А 11,7; С 68,6. Определите отношение k1 и k2 . (k1 /k2 = )
17.8. Для реакции 2А + В D, протекающей по схеме
2А + В С , С + А D ,
рассчитайте стационарную концентрацию вещества С. Совпадает ли эта концентрация с максимальной концентрацией вещества С? Рассчитайте, какое количество вещества В израсходуется к моменту, когда концентрация вещества С достигнет 95% от стационарной, если Ао = Во и k2 = 25 k1 . Какое количество вещества D образуется к этому времени? Определите время, за которое будет получено 95% количества вещества С от стационарного, если Ао = 0,02 моль/л и k1 = 3,010–4 моль/с. (С = моль/л; Смакс = моль/л; хВ = %; хD = ; t = )
17.9.* Составьте кинетические уравнения, если реакция протекает по следующему механизму:
А
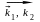 В , В + С
В , В + С
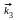 D
.
D
.
Покажите, что при высоких давлениях реакция может протекать по первому порядку, а при низких давлениях – по второму порядку.
17.10. Радиоизотоп Cd118 испытывает превращения по схеме
Cd118
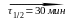 In118
In118
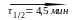 Sn118
(стабилен)
Sn118
(стабилен)
Считая, что в начальный момент препарат содержал 0,1 г только первого изотопа, определите: а) массу стабильного изотопа через 1 час; б) во сколько раз уменьшится активность данного препарата через 1 час. (m = г; в раз)
17.11. Изотоп Sb134 испытывает -радиоактивные превращения по схеме
Sb134
 Te134
Te134
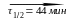 I134
I134
 Xe134
,
Xe134
,
последний изотоп стабилен. Определите относительные количества Te134 и I134 через 1 час, полагая, что в начальный момент препарат содержал только первый изотоп. ( % и %)
17.12. Определите константы скоростей прямой и обратной реакций
транс- CHCl = CHCl цис- CHCl = CHCl
при 573 К на основании данных о концентрации транс- CHCl = CHCl :
-
t , мин
0
600
1080
с , %
95
82,88
75,24
41,89
( = ; = )
17.13. Имеется следующее равновесие:
А
В , В
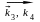 С , С
С , С
 А
А
Как связаны между собой константы k1 – k6 ?
17.14. Найдите период полупревращения вещества А в обратимой реакции первого порядка А В, если Во = 0.
17.15. Найдите время, за которое вещество А распадается на 1/3 в обратимой реакции первого порядка А В, если Во = 0. При каком минимальном значении вещество А никогда не сможет распасться на 1/3?
17.16. Для обратимой реакции первого порядка А В Кравн = 10, а = 0,2 с–1 . Вычислите время, при котором концентрации веществ А и В станут равными, если Во = 0. (t = 3,6 с)
17.17. Цис-транс-изомеризация стильбена (1,2-дифенилэтилена) – обратимая реакция первого порядка. Рассчитайте константы скорости прямой и обратной реакций, используя следующие экспериментальные данные:
t , с |
0 |
1830 |
3816 |
7260 |
12006 |
|
Доля цис-изомера, % |
100 |
88,1 |
79,3 |
70,0 |
48,5 |
17,0 |
( = 6,2810–5 с–1; = 1,2910–5 с–1)
17.18. Определите периоды полупревращения веществ в параллельных реакциях первого порядка (Ао = а, Во = Со = 0):
А ––– |
(k1) |
В |
(k2) |
С |
(1/2 (А) = 1/2 (В) = 1/2 (С) = ln 2/(k1 + k2 ))
17.19. В параллельных реакциях первого порядка
А ––– |
(k1) |
В |
(k2) |
С |
выход вещества В равен 53%, а время превращения А на 1/3 равно 40 с. Найдите k1 и k2 . (k1 = 5,410–3 с–1 , k2 = 4,810–3 с–1)
17.20. Реакция разложения вещества А может протекать параллельно по трем направлениям (все реакции – первого порядка):
А ––– |
(k1) |
В |
(k2) |
С |
|
(k3) |
D |
Концентрации продуктов в смеси через 5 мин. после начала реакции были равны: В = 3,2 моль/л, С = 1,8 моль/л, D = 4,0 моль/л. Определите константы скорости k1 – k3 , если период полураспада вещества А равен 10 мин.
(k1 = 0,025 мин–1 , k2 = 0,014 мин–1 , k3 = 0,031 мин–1)
17.21. Реакция разложения вещества А может протекать параллельно по трем направлениям (все реакции – первого порядка):
А ––– |
(k1) |
В |
(k2) |
С |
|
(k3) |
D |
Концентрации продуктов в смеси через 10 мин. после начала реакции были равны: В = 1,6 моль/л, С = 3,6 моль/л, D = 7,8 моль/л. Определите константы скорости k1 – k3 , если период полураспада вещества А равен 8 мин.
(k1 = 0,011 мин–1 , k2 = 0,024 мин–1 , k3 = 0,052 мин–1)
17.22. Образец радиоактивного урана массой 100 г распадается по схеме
U239
 Np239
Np239
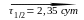 Pu239
Pu239
Рассчитайте массы нептуния и плутония через: 1) 20 мин.; 2) 20 суток после начала распада. Определите максимальную массу нептуния, которая может быть получена из данного образца урана. (1) mNp = 44,5 г, mPu = 0,100 г; 2) mNp = 0,276 г, mPu = 99,7 г; mNp (max) = 96,6 г)
17.23. в системе протекают две параллельные реакции
А + В продукты (k1) , А + С продукты (k2)
Отношение k1 / k2 = 7. начальные концентрации веществ В и С одинаковы. К моменту времени t прореагировало 50% вещества В. Какая часть вещества С прореагировала к этому моменту? (12,5%)
17.24. Константа скорости прямой реакции цис-транс-изомеризации бутена-2 при 417оС равна 8,5210–7 с–1 . Константа равновесия при этой температуре равна 1,14. В начальный момент времени присутствует только цис-изомер. Определите время, за которое прореагирует 30% цис-изомера. (5,99 сут.)
17.25. Константа скорости прямой реакции NH4SCN (NH2)2CS при 25оС равна 7,6610–7 мин–1 . Константа равновесия при этой температуре равна 1,30. В начальный момент времени присутствует только роданид аммония. Определите время, за которое прореагирует 40% исходного вещества. (631 сут.)
17.26.* Найдите зависимость концентрации вещества В от времени в системе
 ,
,
если Ао = а , Во = 0, Со = 0, а константы скорости обеих стадий одинаковы.
( )
)
17.27.* Максимальная концентрация промежуточного продукта в системе двух последовательных реакций первого порядка определяется только отношением констант скорости. Найдите эту максимальную концентрацию в двух предельных случаях: 1) k1 / k2 1; 2) k1 / k2 1. (1) Вmax (ak1 /k2); 2) Вmax a)
17.28.* Реакция изотопного обмена протекает по механизму
А + В С + D ( = = k) .
с
начальными концентрациями Ао
= а,
Во
= b,
Со
= Dо
= 0. Найдите зависимость концентраций
веществ А и В от времени и периоды
полураспада этих веществ. (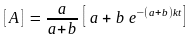 ,
,
,
,
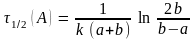 ,
,
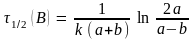 )
)

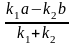 =
=
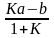
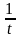 ln
ln
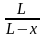

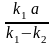 x +
x +
 )
;
)
;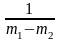 ln
ln
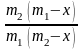 ,
,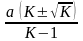 –
–
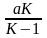 x +
x +
 = 0
= 0
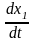 +
+
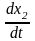 =
=
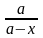
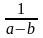 ln
ln
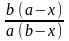
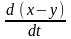 =
=
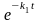 – k2
(x
– y)
– k2
(x
– y)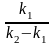 (
–
(
–
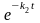 )
;
)
;
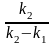 +
)
+
)