
3. В баллоне кислородного изолирующего противогаза (КИП) ёмкостью 1 л находится сжатый кислород. Определить удельный объём и плотность кислорода при указанных условиях. Какой объём займёт данная масса кислорода при нормальных физических условиях, если масса кислорода в баллоне 0,2 кг.
Дано: кислород O2 V=1л m=0,2 кг
|
СИ: Нормальные физические условия н.у.:
Объем 1л = 1·10-3 м3 Молярная масса кислорода O2: М=32·10-3 кг/моль Плотность кислорода O2: ρ=1,429 кг/м3 |
Найти: v -? ρ-? |
Решение.
а) Анализ данных и формул.
Задача на определение параметров состояния газа.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
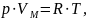
где
p - давление,
VM - молярный объём,
R - универсальная газовая постоянная,
T - абсолютная температура, К.
Так как,
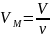
где ν - количество вещества, а
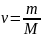 ,
где m - масса, M
- молярная масса, уравнение состояния
можно записать:
,
где m - масса, M
- молярная масса, уравнение состояния
можно записать:
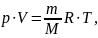
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
Из этой формулы легко выразить объем:
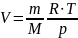
Удельный объём тела (системы):
v = V/m , где V – объём тела (системы) массой m.
Удельная масса (плотность) тела (системы):
= m/V или из уравнения Клапейрона
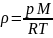
б) Вычисления.
Удельный объем газа, находящегося в баллоне:
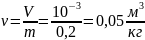
Плотность кислорода, при указанных условиях:
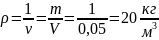
Объем кислорода, при нормальных физических условиях::
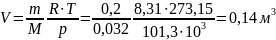
Ответ: удельный объем и плотность кислорода, находящегося в баллоне соответственно равны 0,05 м3/кг и 20 кг/м3; при нормальных условиях объем кислорода той же массы: 0,14 м3
4. Кислород изотермически сжимается до пятикратного уменьшения объёма. Определить объём и давление кислорода после сжатия, работу сжатия и количество тепла, отведённого от газа, если первоначальные объём и давление кислорода и температура соответственно равны
V, м3 |
Р, кПа |
t, °С |
0,6 |
120 |
30 |
Дано: кислород O2 T=const; V1/V2=5 V1=0,6 м3 p1=120 кПа; t1=30°С |
СИ: Т1=30°С=30+273,15=303,15 К p1=120 кПа=120·103 Па Молярная масса кислорода O2: М=32·10-3 кг/моль Плотность кислорода O2: ρ=1,429 кг/м3 |
Найти: V2 , p2, Асж, Q - ? |
Решение.
а) Анализ данных и формул.
Изотермический процесс - термодинамический процесс, происходящий в физической системе при постоянной температуре. (T = const, m = const, M =const).
Уравнение изотермического процесса (закон Бойля – Мариотта):
рV = const ,
где р и V – соответственно давление и объём газа.
Работа расширения газа:
Рис.1. Изотермический процесс.
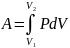
Из уравнения Менделеева-Клапейрона выражаем давление p:

и подставим в уравнение работы:
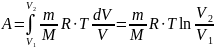
Таким образом, работа в изотермическом процессе:
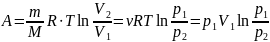
где р1, V1 и p2, V2 – соответственно начальные и конечные значения давления и объёма газа.
Изменение внутренней энергии: U = 0.
Первый закон термодинамики, количество теплоты:
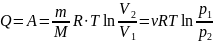
б) Вычисления.
Из закона Бойля-Мариотта следует:
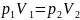
Отсюда найдем давление p2:
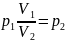
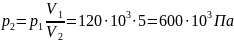
Объем после сжатия V2:
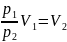

Известно, что масса газа при сжатии не меняется:
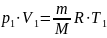
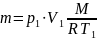
Тогда работа сжатия:
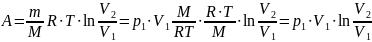
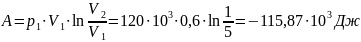
Количество теплоты:
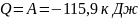
(знак минус указывает на то, что газ сжимается)
Ответ: объём и давление кислорода после сжатия равны соответственно 0,12 м3 и 600кПа, работа сжатия равна количеству тепла, отведённого от газа и равна 115,9 кДж
