
- •43. Понятие функции распределения молекул по скоростям. Распределение Максвелла.
- •29. Явление на границе жидкости и твердого тела. Капилярные явления.
- •45. Барометрическая формула.Распределение Больцмана.
- •48. Закон Джоуля – Ленца в интегральной и дифференциальной формах.
- •6. Теорема Остроградского-Гаусса для напряженности электрического поля в вакууме.
- •19. Уравнение адиабаты для идеального газа
- •20.Взаимная электроемкость двух тел. Электроемкость уединенного проводника. Электроемкость плоского конденсатора.
- •4. Внутренняя энергия идеального газа. Теплоемкость идеального
- •37. Энтропия идеального газа. Изменение энтропии в различных процессах.
- •28. Применение теоремы Острвского-Гаусса
- •57. Адиабатический процесс. Ур-ние Пуассона
- •52.Емкость сферического и плоского конденсатора.
- •51. Закон теплопроводности и диффузии. Коэффициенты переноса энергии и массы в идеальном газе.
- •49. Приведённое количество теплоты. Понятие энтропии. Неравенство клаузиса.
- •50. Потенциальная энергия системы зарядов.
- •40. Правила Кирхгофа для расчета разветвленных электрических цепей.
- •26. Диполь в электрическом поле. Момент сил, действующих на диполь в неоднородном поле.
- •17. Основные понятия термодинамики.
- •18.Условия для напряженности электрического поля и электрического смещения на границе раздела между диэлектриком и проводником.
- •1. Основное уравнение молекулярно-кинетической теории идеального газа
- •13.Изотермы Ван-дер-Вальса и их сравнение с эксперименальными изотермами.
- •14. Электрическое смещение
- •39 Закон вязкого трения, теплопроводности и диффузии в газах
- •2Применение теоремы Остроградского-Гаусса для расчёта напряжённости электрических полей(поле и потенциал равномерно заряжённой сферы)
4. Внутренняя энергия идеального газа. Теплоемкость идеального
U - внутреняя энергия
если газа 1 моль
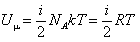
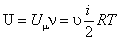 для
произвольной массы газа
для
произвольной массы газа
Эта энергия называется внутренней энергией идеального газа.
внутренней энергией тела называется полная энергия, относящаяся к самим молекулам, т. е. их «невидимая» энергия. Сюда входит кинетическая энергия движения самих молекул, кинетическая энергия движения атомов внутри молекулы (если молекула не одноатомная), потенциальная энергия взаимодействия между атомами внутри молекулы и даже кинетическая энергия частиц, входящих в состав атомов (ядер и электронов). Она, однако, не включает ту кинетическую энергию, которой газ может обладать, если он, как целое, движется, и ту потенциальную энергию, которой он может обладать, если находится в поле каких-нибудь сил. Внутренняя энергия данной массы идеального газа зависит, как это видно из формул, только от температуры и не зависит ни от давления, ни от объема газа. (Для неидеальных газов это неверно.)
Сообщение телу теплоты вызывает изменение его состояния и в общем случае сопровождается изменением температуры. Было замечено, что для нагрева до одной и той же температуры двух различных тел одинаковой массы и в одинаковых условиях требуется различное количество теплоты. Следовательно, существует какое-то свойство тела, определяющее изменение его температуры в процессе подвода или отвода теплоты. Это свойство называют теплоемкостью тела. Таким образом, теплоемкость тела – это величина, характеризующая способность тела изменять свою температуру с подводом или отводом теплоты. Она равна количеству теплоты, которое надо подвести к телу, чтобы изменить его температуру на 1 К:
![]() Дж/К
Дж/К
Молярная теплоемкость C — величина,
равная количеству теплоты, необходимому
для нагревания 1 моль вещества на 1 К:
![]()
Единицей молярной теплоемкости в СИ является джоуль на моль-Кельвин (Дж/моль·К).
46. Плотность энергии электростатического поля
W= ,где E= + ,т.к.векторы напряженности между зарядами и направлены в одну сторону.
37. Энтропия идеального газа. Изменение энтропии в различных процессах.
Энтропия — параметр состояния, дифференциал которого равен отношению бесконечно малого количества теплоты dQ в элементарном обратимом процессе к абсолютной температуре T, постоянной на бесконечно малом участке процесса, т. е.dS = dQ/T
Существуют общие приемы расчета изменений энтропии при различных процессах, связанных с нагревом, охлаждением, плавлением, испарением, химическими реакциями и т. д. Эти приемы, рецепты расчетов составляют неотъемлемую часть термодинамики, и все они основаны на использовании тех или иных опытных данных. Например, чтобы рассчитать изменение энтропии при плавлении ∆Sпл, надо теплоту плавления^ разделить на температуру плавления Tпл. Для плавления 1 моля (18 г) льда λ = 6,02 кДж/моль, а Tпл = 273 К; соответственно ∆Sпл = 22 Дж/моль•град. Энтропия воды больше энтропии льда.
Связь между энтропией S и числом способов реализации данного состояния (термодинамической вероятностью) Р дает известная формула Больцмана:
S = klnP + const, где k=1,38•10-23 Дж/град — постоянная Больцмана.
27. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ЖИДКОСТИ
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ (П.Н) , стремление в-ва (жидкости или твердой фазы) уменьшить избыток своей потенциальной энергии на границе раздела с др. фазой (поверхностную энергию ). Определяется как работа, затрачиваемая на создание единицы площади пов-сти раздела фаз (размерность Дж/м2). Согласно др. определению, П. н.-сила, отнесенная к единице длины контура, ограничивающего пов-сть раздела фаз (размерность Н/м); эта сила действует тангенциально к пов-сти и препятствует ее самопроизвольному увеличению.
П. н.-осн. термодинамич. характеристика поверхностного слоя жидкости на границе с газовой фазой или др. жидкостью. П. н. разл. жидкостей на границе с собств. паром изменяется в широких пределах: от единиц для сжиженных низкокипящих газов до неск. тыс. мН/м для расплавл. тугоплавких в-в. П. н. зависит от т-ры. Для мн. однокомпо-нентных неассоциир. жидкостей (вода, расплавы солей, жидкие металлы) вдали от критич. т-ры хорошо выполняется линейная зависимость:
![]()
где s и s0-П. н. при т-рах T и T0 соотв., a0,1 мН/(м·К)-температурный коэффициент П.н. Осн. способ регулирования П. н. заключается в использовании поверхностно-активных веществ (ПАВ).
Свободная энергия - это работа, совершаемая телом в обратимом изотермическом процессе, равна убыли в этом процессе энергии Гельмгольца рассматриваемого тела
бА=-dF-SdT
