
- •1. Термодинамика многофазной гетерогенной среды
- •2. Вывод выражения для изменения энтропии системы
- •3. Структура выражения для изменения энтропии
- •4. Характеристика производства энтропии
- •5. Структура производства энтропии
- •6. Структура движущей силы массоотдачи
- •7. Колебания при кристаллизации
- •8. Массоперенос с учётом наличия межфазных поверхностей
6. Структура движущей силы массоотдачи
Рассмотрим подробнее структуру движущей силы массоотдачи (массообмена между сплошной фазой и r-фазой), полученной с использованием аппарата механики гетерогенных сред:
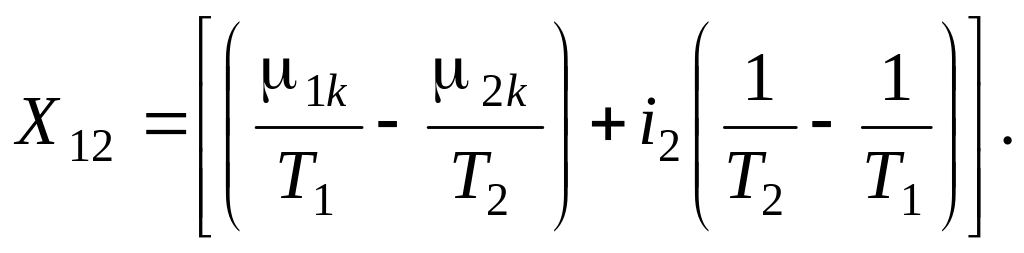 (3.8)
(3.8)
Выражение (3.8) состоит из двух частей:
1. разности химических потенциалов Планка, обусловленной неравновесностью составов фаз
![]()
2. энтальпийной составляющей, характеризующей тепловую неравновесность фаз
![]()
При этом оба фактора равнозначны по своему влиянию на скорость массообмена между фазами.
Следует отметить, что классическая теория массообмена не рассматривает влияние тепловой неравновесности фаз. Данное влияние является синергетическим, то есть учитывает эффекты, непосредственно не связанные с процессом межфазного массообмена. Оно впервые было получено именно из анализа производства энтропии многофазной полидисперсной среды. Таким образом, выражение (3.8) для движущей силы массоотдачи имеет элемент новизны.
Если в процессе межфазного массообмена температура фаз практически не изменяется, то энтальпийной составляющей можно пренебречь и описывать процесс массообмена классическими зависимостями. Однако если процессы межфазного массообмена сопровождаются большими тепловыми эффектами, в системе могут происходить явления, которые на основе классической теории массообмена объяснить невозможно; для их объяснения требуется учёт тепловой неравновесности. В качестве примера рассмотрим аномальные явления, наблюдающиеся при кристаллизации фосфорной кислоты.
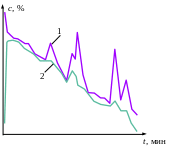
7. Колебания при кристаллизации
фосфорной кислоты
В процессе кристаллизации фосфорной кислоты из растворов (85-87 %) при понижении температуры могут наблюдаться колебания концентрации фосфорной кислоты (см. рисунок). Уменьшение концентрации раствора соответствует нормальному течению процесса кристаллизации, то есть образованию и росту кристаллов. Повышение концентрации раствора означает, что в данный момент времени доминирует обратный процесс – растворение кристаллов. Однако при этом кривая текущей концентрации раствора фосфорной кислоты (кривая 1) не пересекает кривую равновесной концентрации (кривая 2), а находится выше неё при тех же температурных условиях. Таким образом, наблюдаемое периодическое растворение кристаллов происходит в условиях пересыщенного раствора.
Для объяснения описанного явления рассмотрим движущую силу процесса кристаллизации (3.8), полученную на основе аппарата механики гетерогенных сред и анализа производства энтропии. С учётом соотношений для химических потенциалов и энтальпии
![]()
выражение (3.8) приводится к виду:
![]() (3.9)
(3.9)
где
![]() – концентрация раствора фосфорной
кислоты,
– концентрация раствора фосфорной
кислоты,
![]() – равновесная концентрация раствора
фосфорной кислоты,
– равновесная концентрация раствора
фосфорной кислоты,
![]() – теплоёмкость кристаллов фосфорной
кислоты, R – универсальная
газовая постоянная; индекс k
в формулах опущен, поскольку рассматривается
только один компонент – фосфорная
кислота.
– теплоёмкость кристаллов фосфорной
кислоты, R – универсальная
газовая постоянная; индекс k
в формулах опущен, поскольку рассматривается
только один компонент – фосфорная
кислота.
Поскольку процесс кристаллизации ведётся при пересыщении, концентрация раствора фосфорной кислоты больше равновесной, и, следовательно, первое слагаемое в правой части уравнения (3.9) положительно. Величина теплового эффекта при кристаллизации фосфорной кислоты достигает значения 223,4 кДж/кг, поэтому температура кристаллов фосфорной кислоты Т2 постоянно превышает температуру раствора Т1, и, следовательно, второе слагаемое в правой части уравнения (3.9) отрицательно. В зависимости от того, какое из слагаемых в тот или иной момент времени больше по абсолютной величине, процесс роста кристаллов может чередоваться с их растворением не смотря на то, что раствор остаётся при этом пересыщенным.
