
- •7. Основи молекулярно-кінетичної теорії ідеальних газів.
- •7.1. Рівняння стану ідеальних газів.
- •7.2. Ізопроцеси.
- •7.3. Внутрішня енергія ідеального газу.
- •8. Елементи термодинаміки.
- •8 .1. Робота газу.
- •8.2. Перший закон термодинаміки.
- •8.3. Адіабатний процес.
- •8.4. Циклічні процеси. Тепловий двигун. Холодильна машина.
- •8.5. Зміна ентропії у термодинамічних процесах.
- •9. Явища переносу.
- •10. Реальні гази
- •10.1. Рівняння стану реального газу.
- •10.2. Критичний стан.
- •Задачі для самостійного розв’язання.
- •11. Фазові перетворення. Насичена пара. ВЛастивості рідин
- •12. Елементи статистики. Розподіл молекул по швидкостям та енергіям.
- •Графічні задачі і приклади тестових запитань
- •Перелік рекомендованої літератури.
7.3. Внутрішня енергія ідеального газу.
Внутрішня
енергія будь – якої системи дорівнює
сумі кінетичної енергії теплового руху
молекул та потенціальної енергії їх
взаємодії між собою. Для виділеного
об’єму ідеального газу внутрішня
енергія представляє собою суму кінетичних
енергій теплового руху усіх молекул в
даному об’ємі (потенціальною енергією
взаємодії молекул між собою нехтуємо).
Як відомо, числом ступенів свободи тіла
i
називають число незалежних координат,
за допомогою яких можна визначити його
положення в просторі. Згідно з цим
визначенням, одноатомна молекула буде
мати 3 ступеня свободи, двохатомна
жорстка (при відсутності коливань в
молекулі) – 5, трьохатомна жорстка – 6.
У відповідності до теореми
Больцмана,
на кожну ступінь свободи молекули
припадає енергія
![]() .
Отже, середня енергія теплового руху
однієї молекули з числом ступенів
свободи i
дорівнює
.
Отже, середня енергія теплового руху
однієї молекули з числом ступенів
свободи i
дорівнює
![]() =
=![]() =
=![]() ,
(9)
,
(9)
де
![]() –
число ступенів свободи молекули, а
середньоквадратична
швидкість
молекули
–
число ступенів свободи молекули, а
середньоквадратична
швидкість
молекули
![]() визначається
виразом
визначається
виразом
=![]() =
=![]() . (10)
. (10)
і внутрішня енергія одного молю газу становить
![]() =
=![]()
![]() .
(11)
.
(11)
Одноатомний газ ( інертні гази: гелій Не, неон Ne, аргон Ar, криптон Kr, ксенон Xe, атомарні гази) |
|
Двохатомний газ (кисень О2, водень Н2, азот N2, пара йоду J2), вуглекислий газ СО2 (виняток) |
= 5 |
Багатоатомний газ (водяна пара Н2О, аміак NH3, закис азоту N2О, метан СН4) |
= 6 |
Основне рівняння кінетичної теорії газів зв’язує тиск газу з середньою кінетичною енергією поступального руху молекул
![]() =
=![]()
![]() =
=![]() =
=![]()
![]() . (12)
. (12)
8. Елементи термодинаміки.
8 .1. Робота газу.
При
зміні об’єму газу на величину
![]() він
виконує елементарну роботу
він
виконує елементарну роботу
![]() . (13)
. (13)
Якщо ця величина позитивна, то газ розширюється і виконує роботу над зовнішніми тілами. Якщо цей вираз негативний, то зовнішні тіла виконують роботу над газом і стискають його.
Повна
робота при зміні об’єму газу від
початкового об’єму
![]() до кінцевого
до кінцевого
![]() визначається
інтегралом
визначається
інтегралом
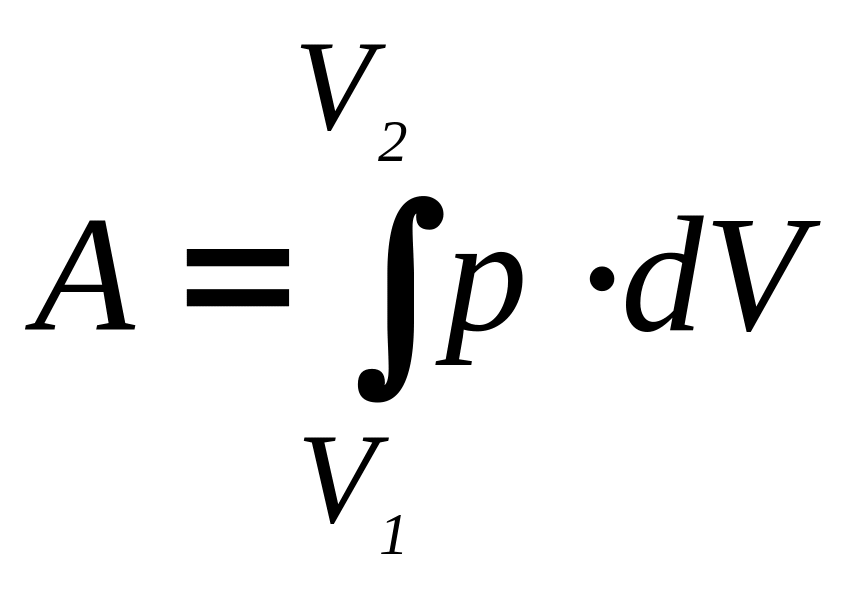 .
(14)
.
(14)
На
рис.2 в координатах p-V
показано перехід газу зі стану 1 до
стану 2, які відрізняються набором
термодинамічних параметрів (p,
V, T).
Роботу у такому процесі характеризує
площа заштрихованої фігури (криволінійної
трапеції, обмеженої ізохорами
![]() і
).
Очевидно, що робота залежить від вигляду
функції
і
).
Очевидно, що робота залежить від вигляду
функції
![]() ,
тобто від термодинамічного процесу, у
якому газ змінює свій об’єм. Для окремих
випадків – відомих ізопроцесів –
значення роботи представлені в таблиці:
,
тобто від термодинамічного процесу, у
якому газ змінює свій об’єм. Для окремих
випадків – відомих ізопроцесів –
значення роботи представлені в таблиці:
-
Ізобарний процес
( =const)
 ∙(
∙(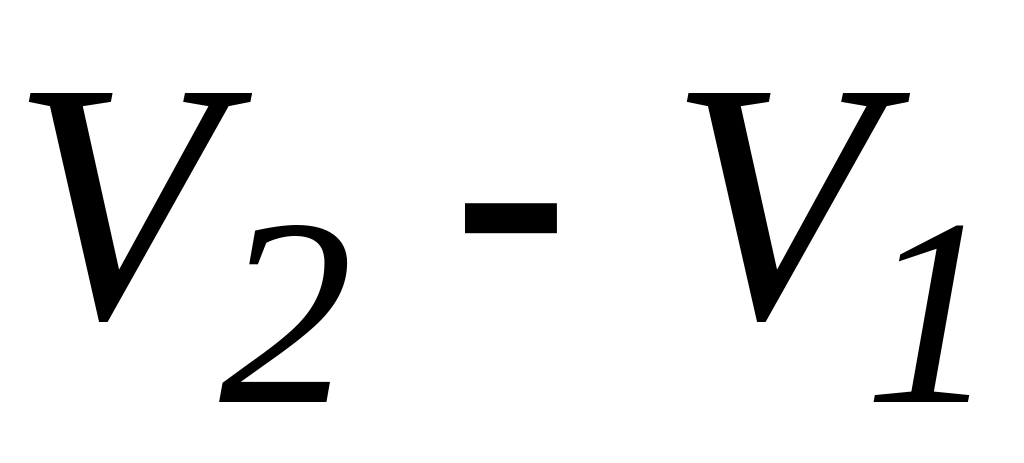 )
)(15)
Ізотермічний процес
(
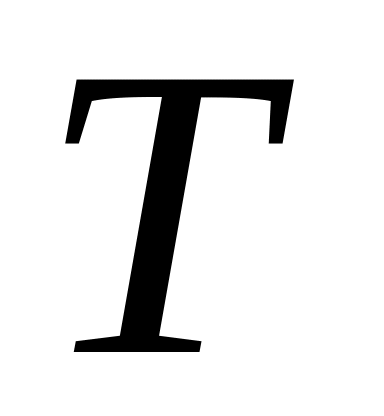 =const)
=const)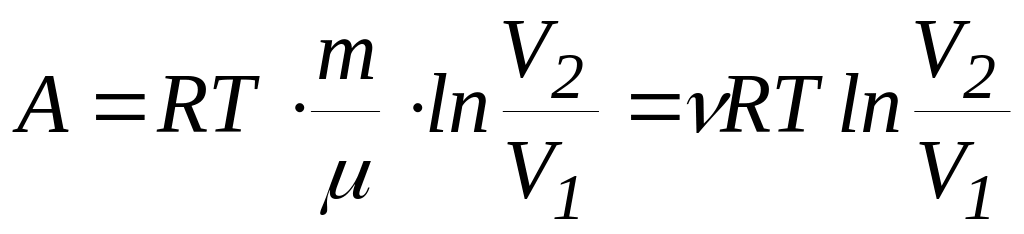
(16)
Ізохорний процес
(
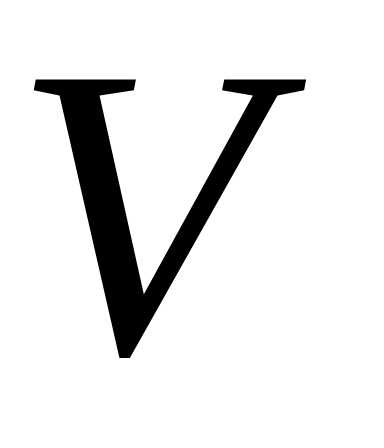 =const)
=const)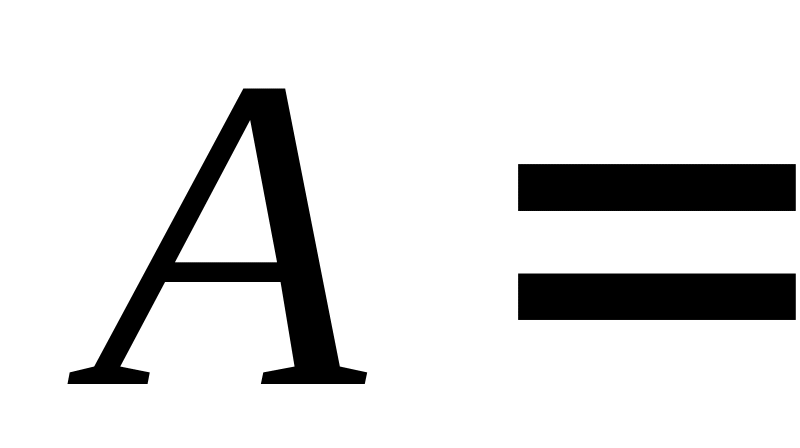 0
0(17)
