
- •Минобрнауки россии
- •305040, Г. Курск, ул. 50 лет Октября, 94. Оглавление
- •Раздел 3. Квантовая физика и физика атома 5
- •Раздел 4. Ядерная физика и физика элементарных частиц 45
- •Раздел 3. Квантовая физика и физика атома
- •3.1. Корпускулярно-волновой дуализм свойств частиц. Волны де Бройля. Принцип неопределённостей Гейзенберга
- •3.1.1. Соотношение неопределенностей
- •Примеры решения задач
- •3.2. Уравнение Шрёдингера
- •3.3. Простейшие задачи квантовой механики
- •3.3.1. Прохождение частиц через потенциальный барьер
- •3.3.2. Движение частиц в одномерной яме с абсолютно непроницаемыми стенками
- •3.4. Спектр атома водорода. Правила отбора. Теория Бора для водородоподобных систем
- •3.5. Модель атома водорода Бора
- •3.6. Квантовомеханическая модель атома водорода
- •3.7. Векторная модель атома
- •Принцип запрета Паули
- •Если учесть наличие спина у электрона, то .
- •Раздел 4. Ядерная физика и физика элементарных частиц
- •4.1. Радиоактивность. Состав атомных ядер.
- •4.2. Превращение атомных ядер
- •4.2.1. Законы радиоактивного распада
- •4.2.2. Активность радиоактивного вещества
- •4.3. Ядерные реакции. Элементарные частицы
- •4.3.1. Искусственная радиоактивность, ядерные реакции
- •4.3.1. Законы сохранения в ядерных реакциях
- •4.3.2. Основные характеристики элементарных частиц
- •4.3.3. Изотопический спин
3.7. Векторная модель атома
Д вижение
электронов в других атомах, помимо атома
водорода,
определяется теми же квантовыми числами
n,
ℓ, j,
mℓ,
ms.
Но влияние на движение электрона других
электронов приводит к тому, что его
энергия зависит кроме n
и от квантового числа ℓ.
вижение
электронов в других атомах, помимо атома
водорода,
определяется теми же квантовыми числами
n,
ℓ, j,
mℓ,
ms.
Но влияние на движение электрона других
электронов приводит к тому, что его
энергия зависит кроме n
и от квантового числа ℓ.
Механические и магнитные моменты атомов складываются из орбитальных и спиновых моментов отдельных электронов.
Возможны два случая:
1.
Если орбитальные моменты
![]() связаны между собой сильнее, чем с
связаны между собой сильнее, чем с
![]() и
наоборот (такая связь называется
LS-связью),
то все моменты
складываются в суммарный орбитальный
момент атома
и
наоборот (такая связь называется
LS-связью),
то все моменты
складываются в суммарный орбитальный
момент атома
![]() ,
а все
в
суммарный спиновый момент
,
а все
в
суммарный спиновый момент
![]() .
А затем находится полный момент атома
.
А затем находится полный момент атома
![]() .
.
Результирующий орбитальный момент импульса для SL-связи
![]() ,
,
где L – орбитальное квантовое число атома.
Для
двух электронов
![]() .
.
Проекция момента импульса атома на некоторое направление
![]()
![]()
Также и для полного спинового момента
![]()
![]()
Тогда полный орбитальный момент атома
![]()
![]()
![]()
Векторная
модель строится по следующим правилам.
Пусть известен модуль момента импульса
и одна из его проекций М
и Мz
(Мx
и Мy
– не определены). Следовательно,
![]() может
иметь направление одной из образующих
конуса (совершает прецессию).
может
иметь направление одной из образующих
конуса (совершает прецессию).
То, что проекция полного момента атома квантуется, было доказано в опыте Штерна и Герлаха.
Принцип запрета Паули
Состояние электронов в атомах позволяет объяснить принцип запрета Паули:
В
одном и том же атоме (или другой квантовой
системе) не может быть двух электронов
(либо других частиц со спином
![]() ),
обладающих одинаковой совокупностью
квантовых чисел. (В одном и том же
состоянии не могут находиться 2 и более
электронов).
),
обладающих одинаковой совокупностью
квантовых чисел. (В одном и том же
состоянии не могут находиться 2 и более
электронов).
Принцип Паули дает объяснение периодической повторяемости свойств атомов.
Распределение
электронной плотности для состояний с
заданным главным числом n,
но с разными значениями орбитального
ℓ и магнитного m
- квантовых чисел, существенно отличаются.
Хотя, согласно формуле (![]() ),
им соответствует одна и та же энергия
(
),
им соответствует одна и та же энергия
(![]() ).
Ситуация, когда одному и тому же
энергетическому уровню
).
Ситуация, когда одному и тому же
энергетическому уровню
![]() соответствует несколько различных
квантовых состояний систем (волновые
функции
соответствует несколько различных
квантовых состояний систем (волновые
функции
![]() отличаются значениями mℓ
и ℓ), называется вырождением уровня
энергии. Уровень энергии называется
невырожденным, если ему отвечает лишь
одно состояние
отличаются значениями mℓ
и ℓ), называется вырождением уровня
энергии. Уровень энергии называется
невырожденным, если ему отвечает лишь
одно состояние
![]() и g,
кратно вырожденным, если система в g
различных состояниях
имеет
одинаковую энергию.
и g,
кратно вырожденным, если система в g
различных состояниях
имеет
одинаковую энергию.
В
атоме водорода при заданном числе n
орбитальное квантовое число ℓ может
принимать n
значений
![]() ,
а магнитное квантовое число mℓ
изменяется в пределах: -ℓ-+ℓ и следовательно
принимает 2ℓ+1 значений.
,
а магнитное квантовое число mℓ
изменяется в пределах: -ℓ-+ℓ и следовательно
принимает 2ℓ+1 значений.
Поэтому кратность вырождения g - уровня энергии определяется суммой арифметической прогрессии.
![]()
Если учесть наличие спина у электрона, то .
|
|
|
Оболочка |
На уровне с энергией |
n = 1 |
2 эл. |
K |
|
n = 2 |
8 эл. |
L |
|
n = 3 |
18 эл. |
M |
|
n = 4 |
32 эл. |
N |
|
n = 5 |
50 эл. |
O |
|
|
|
P |
Задания к теме
Задание 51
З акон
сохранения момента импульса накладывает
ограничения на возможные переходы
электрона в атоме с одного уровня на
другой (правило отбора). В энергетическом
спектре атома водорода (рис) запрещенным
переходом является…
акон
сохранения момента импульса накладывает
ограничения на возможные переходы
электрона в атоме с одного уровня на
другой (правило отбора). В энергетическом
спектре атома водорода (рис) запрещенным
переходом является…
*1) 3s - 2s; 2) 3s - 2p;
3) 3d - 2p; 4) 4s - 3p.
Задание 52
З акон
сохранения момента импульса накладывает
ограничения на возможные переходы
электрона в атоме с одного уровня на
другой (правило отбора). В энергетическом
спектре атома водорода (рис) запрещенным
переходом является…
акон
сохранения момента импульса накладывает
ограничения на возможные переходы
электрона в атоме с одного уровня на
другой (правило отбора). В энергетическом
спектре атома водорода (рис) запрещенным
переходом является…
*1) 4s - 3d; 2) 2p - 1s;
3) 4s - 3p; 4) 3s - 2p.
Задание 53
Закон сохранения момента импульса накладывает ограничения на возможные переходы электрона в атоме с одного уровня на другой (правило отбора). В энергетическом спектре атома водорода (рис) запрещенным переходом является…
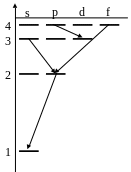
*1) 4f - 2p;
2) 4p - 3d;
3) 2p - 1s;
4) 3s - 2p.
Задание 54
З акон
сохранения момента импульса накладывает
ограничения на возможные переходы
электрона в атоме с одного уровня на
другой (правило отбора). В энергетическом
спектре атома водорода (рис) запрещенным
переходом является…
акон
сохранения момента импульса накладывает
ограничения на возможные переходы
электрона в атоме с одного уровня на
другой (правило отбора). В энергетическом
спектре атома водорода (рис) запрещенным
переходом является…
*1) 4d - 2s; 2) 4s - 3p;
3) 3d - 2p; 4) 2p - 1s.
Задание 55
Видимой части спектра излучения атома водорода соответствует формула
*1)
![]() ;
2)
;
2)
![]() ;
;
3)
![]() ;
4)
;
4)
![]() .
.
Задание 56
Н а
рисунке представлена диаграмма
энергетических уровней атома водорода.
Поглощение фотона с наибольшей длиной
волны происходит при переходе, обозначенном
стрелкой номер …
а
рисунке представлена диаграмма
энергетических уровней атома водорода.
Поглощение фотона с наибольшей длиной
волны происходит при переходе, обозначенном
стрелкой номер …
1); 2); 3); 4); *5).
Задание 57
Н а
рисунке изображены стационарные орбиты
атома водорода согласно модели Бора, а
так же условно изображены переходы
электрона с одной стационарной орбиты
на другую, сопровождающиеся излучением
кванта энергии. В ультрафиолетовой
области спектра эти переходы дают серию
Лаймана, в видимой
серию Бальмера, в инфракрасной
серию Пашена.
а
рисунке изображены стационарные орбиты
атома водорода согласно модели Бора, а
так же условно изображены переходы
электрона с одной стационарной орбиты
на другую, сопровождающиеся излучением
кванта энергии. В ультрафиолетовой
области спектра эти переходы дают серию
Лаймана, в видимой
серию Бальмера, в инфракрасной
серию Пашена.
Наибольшей частоте кванта в серии Лаймана соответствует
*1) n=5 → n=1;
2) n=2 → n=1;
3) n=5 → n=3;
4) n=3 → n=2.
Задание 58
Н а рисунке изображены стационарные орбиты атома водорода согласно модели Бора, а так же условно изображены переходы электрона с одной стационарной орбиты на другую, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой серию Бальмера, в инфракрасной серию Пашена.
Наименьшей частоте кванта в серии Лаймана соответствует…
*1) n=2 → n=1;
2) n=5 → n=1;
3) n=4 → n=;
4) n=5 → n=3.
Задание 59
Магнитное квантовое число m определяет…
*1) проекцию орбитального момента импульса электрона на заданное направление;
2) собственный механический момент электрона в атоме;
3) орбитальный механический момент электрона в атоме;
4) энергию стационарного состояния электрона в атоме.
Задание 60
Азимутальное квантовое число l определяет…
*1) орбитальный механический момент электрона в атоме;
2) собственный механический момент электрона в атоме;
3) энергию стационарного состояния вэлектрона в атоме;
4) проекцию орбитального момента импульса электрона на заданное направление.
Задание 61
На рисунке приведена одна из возможных ориентаций момента импульса электрона в р-состоянии. Какие еще значения может принимать проекция момента импульса на направление Z внешнего магнитного поля?
1 ) 2 ;
*2) ;
*3) ;
4) 2 .
Задание 62
В
единицах постоянной Планка
![]() спин электрона равен …
спин электрона равен …
*1) 1/2; 2) 1; 3); 4) 3/2.
Задание 63
Электрон в атоме водорода перешёл из основного состояния в возбуждённое с n = 3. Радиус его боровской орбиты …
*1) увеличился в 9 раз; 2) увеличился в 2 раза;
3) увеличился в 3 раза; 4) уменьшился в 3 раза; 5) не изменился.
Задание 64
В атоме водорода K и L оболочки заполнены полностью. Общее число электронов в атоме равно……
*1) 10; 2) 8; 3) 28; 4) 6.
Задание 65
Энергия
электрона в атоме водорода определяется
значением главного квантового числа
n.
Если
![]() ,
то n
равно…
,
то n
равно…
*1) 3 2) 4 3) 5 4) 2
